在生命的密码中,血型系统如同精密的生物识别标签,其中ABO血型作为人类最早发现的血型分类系统,其抗原与抗体的特殊配对关系始终是医学研究的焦点。A型血群体占全球人口约30%,其血清中独有的抗B抗体不仅构建了输血安全的基石,更在免疫防御、疾病易感性乃至母婴健康领域展现出复杂的生物学特性。这种天然抗体的存在,既是生命进化赋予的防御武器,也可能成为特定病理过程的触发因子,揭示着人类血液免疫系统的精妙平衡。
一、A型血的抗体特征
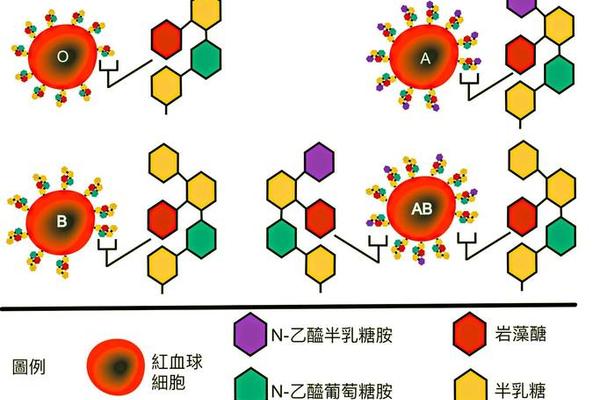
A型血个体的免疫系统携带独特的抗体组合,其红细胞表面分布着A抗原,而血浆中则存在抗B抗体。这种抗原-抗体分布的形成源于ABO基因座的显性遗传规律:A型基因(IA)编码产生将N-乙酰半乳糖胺连接到H抗原末端的转移酶,从而形成A抗原;机体通过免疫识别机制,对非己的B抗原产生IgM类抗B抗体。实验室研究显示,抗B抗体在盐水中即可引发强烈的凝集反应,其效价通常在1:128以上,这种特性使其成为血型鉴定时的重要检测指标。
抗体类型的多样性在A型血群体中尤为显著。除主要的IgM类天然抗体外,某些特定条件下(如异型输血或妊娠),机体可能产生IgG类免疫性抗B抗体。这类抗体虽无法直接引发红细胞凝集,却能够穿过胎盘屏障,成为新生儿溶血病的重要诱因。血清学分析表明,抗B抗体的热敏感性特征显著,在50-60℃环境下即可发生解离,这一特性被广泛应用于抗体放散试验等临床检测技术。
二、抗体的免疫防御机制
抗B抗体的核心功能在于维持免疫稳态。当B型红细胞进入A型血个体循环系统时,抗体通过Fab段特异性结合B抗原表位,形成抗原-抗体复合物。这种结合不仅激活补体系统的经典途径(C1q至C9的级联反应),还能通过Fc段与吞噬细胞表面的Fcγ受体结合,形成调理吞噬作用,最终导致异源红细胞的溶解清除。研究发现,每毫升A型血清中的抗B抗体可中和约1×10^8个B型红细胞,这种强大的清除能力构成了输血安全的第一道防线。
在病原体防御领域,抗B抗体的交叉保护作用引人注目。某些肠道细菌(如大肠杆菌086)的细胞壁多糖结构与B抗原高度相似,抗B抗体可通过分子拟态机制识别并中和这类病原体。流行病学数据显示,A型血人群对霍乱弧菌感染的抵抗力显著强于B型血群体,这种保护效应被认为与抗B抗体的交叉反应有关。但值得注意的是,这种保护具有选择性,研究显示A型血个体对诺如病毒GII.4型的易感性反而较高,揭示出血型抗体防御机制的复杂性。
三、临床医学中的双重角色
输血医学领域,抗B抗体既是安全保障又是技术挑战。根据国际输血协会指南,A型受血者仅能接受A型或O型红细胞制品,若误输B型血,抗B抗体可在数分钟内引发弥散性血管内凝血。临床案例显示,200ml异型输血即可导致超过50%的红细胞发生溶血,释放的血红蛋白可引发急性肾损伤。为应对抗体效价过高患者的输血需求,血站采用血浆置换技术将抗体浓度降低至安全阈值,该过程通常需要置换3-4倍血浆容量。
母婴健康领域,抗B抗体的动态监测至关重要。当O型血母亲怀有B型胎儿时,母体产生的IgG类抗B抗体可透过胎盘引发新生儿溶血病。北京妇产医院2023年数据显示,此类病例占新生儿溶血的68%,通过产前抗体效价监测联合光疗干预,可将重症发生率从12%降至2.7%。最新研究还发现,抗B抗体可能影响胎盘滋养层功能,A型血孕妇的流产率与抗B效价呈正相关(r=0.32, p<0.01),这为复发性流产的免疫治疗提供了新思路。
四、遗传进化与群体差异
从人类遗传学视角,抗B抗体的分布呈现显著地理差异。基因测序发现,IA等位基因在东亚人群中的频率高达28%,远高于欧洲人群的17%,这种差异可能与历史上瘟疫的选择压力有关。分子考古学研究显示,IA基因的扩张期与腺鼠疫大流行时期高度重合,提示抗B抗体可能通过交叉免疫提供生存优势。但在现代医学背景下,这种遗传特征正面临新的挑战——基因编辑技术已实现ABO基因座的定向修饰,未来或可通过造血干细胞编辑消除抗体引发的输血障碍。
五、未来研究方向
随着单细胞测序技术的突破,科学家发现抗B抗体的产生不仅依赖浆细胞,肠道相关淋巴组织(GALT)中的B1细胞也贡献了约30%的抗体产量,这为调控抗体水平提供了新靶点。在疾病治疗领域,抗B抗体的工程化改造成为研究热点,通过Fc段糖基化修饰获得的低补体激活型抗体,已在灵长类动物实验中展现出安全输注异型红细胞的潜力。这些突破预示着,对A型血抗体的深入研究将继续推动输血医学、器官移植和免疫治疗的革新。
生命的密码在血型抗体中书写着双重叙事:既是守护健康的忠诚卫士,也是需要理性驾驭的双刃剑。从Landsteiner发现ABO血型系统至今,对抗B抗体的认知已从简单的凝集现象深入到分子免疫层面。在精准医学时代,通过多组学技术解析抗体的动态调控网络,结合基因编辑和抗体工程技术,人类终将实现从被动防御到主动调控的跨越,让这传承百万年的免疫遗产更好地服务于健康未来。


