人类对血液奥秘的探索始终与生命科学的发展交织。自1900年兰德斯坦纳发现ABO血型系统以来,科学家们逐步揭示了血型抗原的分子本质——糖链结构差异决定了ABO血型的多样性。而在这套经典分类之外,Rh血型系统中的RhD阴性因其罕见性被称为"熊猫血",二者共同构成了输血医学的基石。理解这些血型系统的分子机制,不仅关乎临床输血安全,更为基因治疗和人工血液研发提供了重要启示。
ABO抗原的糖链密码
ABO血型系统的本质差异源于红细胞膜表面糖鞘脂分子末端的糖基排列。1960年瓦特金斯团队通过化学分析发现,A型抗原的末端是N-乙酰半乳糖胺,B型为半乳糖,而O型仅保留前体H抗原的岩藻糖结构。这种微小的糖基差异由9号染色体上的ABO基因调控,A和B基因分别编码特异性糖基转移酶,催化相应糖基的添加,O基因则因移码突变丧失酶活性。
从生物合成路径来看,所有ABO抗原都起源于H抗原。H抗原本身由FUT1基因编码的岩藻糖转移酶构建,其作为基础结构为后续修饰提供平台。当个体携带A基因时,其表达的N-乙酰半乳糖胺转移酶会将H抗原转化为A抗原;若携带B基因则添加半乳糖形成B抗原。这种酶促反应的专一性解释了为何AB型血液能同时呈现两种抗原。
熊猫血的RhD阴性本质
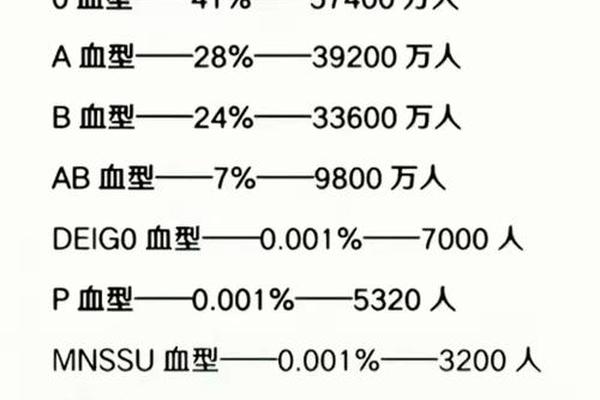
Rh血型系统的复杂性远超ABO,其中D抗原的存在与否直接定义了"熊猫血"。1940年Landsteiner在恒河猴实验中发现的D抗原,在人类中呈现高度多态性。Rh阴性个体因1号染色体上的RHD基因缺失或突变,导致红细胞表面缺失D抗原,这种表型在白种人中占15%,但在中国汉族中仅0.2-0.5%。
遗传学研究表明,RhD阴性遵循隐性遗传规律。当父母双方均为Dd杂合子时,子女有25%概率呈现dd纯合子表型。值得注意的是,Rh抗原仅表达于红细胞,与ABO抗原广泛分布于体液的特征形成鲜明对比。这种组织特异性使得Rh阴性孕妇在怀Rh阳性胎儿时,母体免疫系统可能通过胎盘接触D抗原产生IgG抗体,导致新生儿溶血。
临床输血的双重考量
在输血实践中,ABO和Rh血型的匹配具有同等重要性。ABO不相容会引发急性溶血反应,因其天然抗体多为IgM型,能快速激活补体系统。而RhD阴性患者输入阳性血液后,虽不会立即发生反应,但会产生记忆性IgG抗体,致使二次输血时发生迟发性溶血。这解释了为何"万能供血者"O型血仍需严格筛查RhD状态。
新生儿溶血病的防治凸显血型知识的临床价值。ABO系统溶血多发生于O型母亲与非O型胎儿间,因母体天然IgG抗体经胎盘传递,但症状较轻;而RhD溶血则具有剂量效应,首胎通常安全,次胎可能引发严重贫血。现代医学通过抗D免疫球蛋白注射阻断母体致敏,使Rh阴性孕妇生育安全率大幅提升。
未来研究的突破方向
浙江大学团队2020年开发的"通用熊猫血"技术,通过聚唾液酸-盐酸酪胺凝胶网络掩蔽D抗原,在动物实验中实现Rh阳性红细胞的安全输注,为突破血源短缺提供了新思路。基因编辑技术的进步使精准修饰ABO基因成为可能,日本学者已成功将B型红细胞转化为O型。表观遗传学研究则发现,DNA甲基化可能调控ABO抗原表达强度,这为肿瘤免疫治疗中的血型抗原调控带来启示。
建立区域性稀有血型库、开发血型转换生物材料、探索基因疗法重建血型抗原,构成未来研究的三大方向。公众教育方面,需加强Rh阴性人群的生育指导,推广血型信息的基因检测,并通过区块链技术实现稀有血型资源的动态管理。
血型系统的研究跨越了整整两个世纪,从最初的血清学观察到如今的分子生物学解析,每一次突破都在改写临床实践的标准。糖链结构的精巧编排与基因表达的复杂调控,共同编织着人类血液的遗传密码。在精准医疗时代,深入理解这些生物学基础,将推动输血医学迈向个体化、安全化的新纪元。


