人类对血液奥秘的探索始于20世纪初,兰茨泰纳发现ABO血型系统后,输血医学迈入科学化时代。其中,A型血因携带抗B抗体的独特血清学特征,成为理解血型免疫反应的关键切入点。抗B抗体与B型红细胞的凝集现象不仅是血型鉴定的基础,更关乎输血安全、器官移植配型及新生儿溶血病防治等临床核心问题。随着分子生物学技术的发展,ABO血型抗原的遗传机制与抗体功能研究不断深化,为精准医疗提供了新的视角。
一、ABO血型系统的抗原抗体机制
ABO血型系统的核心在于红细胞表面抗原与血清抗体的特异性结合。A型个体红细胞膜上表达A型糖基转移酶催化形成的A抗原,其血清中天然存在抗B抗体。这种抗体属于IgM型免疫球蛋白,可在盐水介质中直接引发B型红细胞的凝集反应。分子遗传学研究显示,ABO基因位于第9号染色体长臂3区4带,A等位基因通过编码α-1,3-N-乙酰半乳糖胺转移酶,催化H抗原转化为A抗原。
抗原抗体的空间构象决定反应特异性。抗B抗体的Fab段与B抗原的α-D-半乳糖残基形成互补结合,通过多价结合引发红细胞交联。研究证实,每毫升A型血清中抗B抗体效价需达到1:128以上才能确保检测灵敏度。这种严苛的质量标准源于临床实践教训——1940年代英国曾因抗血清效价不足导致血型误判,引发多起输血事故。
二、血型鉴定的方法学演进
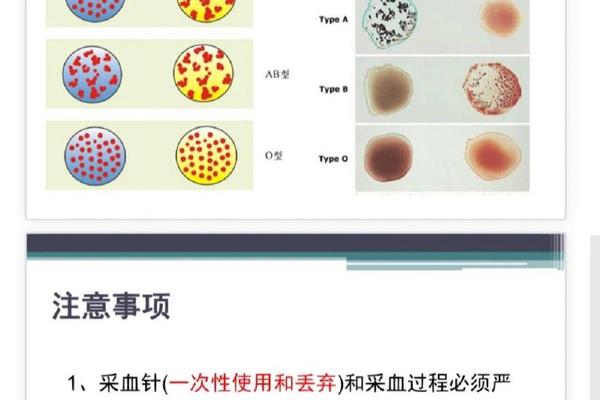
传统的玻片法利用抗B血清与待检红细胞直接反应,操作简便但灵敏度有限。试管法则通过离心加速抗原抗体结合,使检测时间从30分钟缩短至5分钟,尤其适用于急诊输血。微柱凝胶法的创新在于将抗人球蛋白试验整合到凝胶介质中,利用分子筛效应增强凝集可视化,其检测灵敏度比试管法提高5个滴度,可识别0.1%的抗原变异。
方法学的进步伴随着标准化进程。2015版《全国临床检验操作规程》明确规定:抗B血清必须与B3亚型红细胞发生强凝集,而与A2B细胞无交叉反应。临床实践中发现,约0.01%的A型个体存在抗B抗体缺失现象,此类特殊案例需联合分子诊断技术确认ABO基因型,避免单纯依赖血清学检测造成的误判。
三、临床实践中的特殊挑战
在器官移植领域,A型供体的抗B抗体会攻击B型受者的血管内皮细胞,引发超急性排斥反应。2019年《新英格兰医学杂志》报道的跨血型心脏移植案例中,通过免疫吸附柱清除受者血型抗体,成功实现ABO不相容移植。这提示抗B抗体的清除技术可能改写传统配型规则。
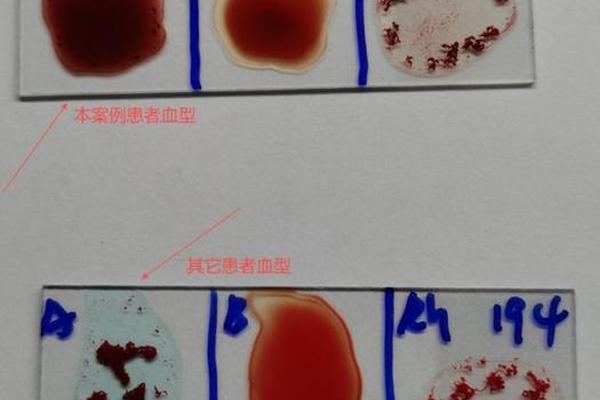
新生儿溶血病防治更凸显抗B抗体的双刃剑特性。当O型母亲怀有B型胎儿时,母体IgG型抗B抗体可经胎盘引发胎儿红细胞溶解。北京协和医院的研究显示,孕中期抗B效价>1:256时,新生儿换血治疗率达83%。而A型母亲因天然IgM抗体无法通过胎盘,相关溶血风险显著降低,这为产前干预策略提供了重要依据。
四、前沿研究与技术突破
单克隆抗体技术的突破使抗B检测进入精准时代。第三代重组抗B单抗通过基因工程技术去除Fc段非特异性结合位点,将检测特异性提升至99.99%。冷冻电镜研究揭示,抗B抗体与B抗原的结合存在两种模式:高亲和力结合引发不可逆凝集,低亲和力结合则导致可逆性弱凝集,这为解释亚型现象提供了分子基础。
基因编辑技术正在改写血型认知框架。2023年《自然》子刊报道,通过CRISPR-Cas9敲除HEK293细胞的ABO基因,成功制备通用型O红细胞。该技术若能临床转化,将彻底改变依赖天然抗体的血型匹配模式,但如何调控抗B抗体的生物合成仍是待解难题。
五、未来发展方向
当前研究存在三方面局限:约5%的弱A亚型样本仍无法被现有试剂准确识别;抗B抗体的个体差异机制尚未完全阐明;人工合成血型抗原的稳定性有待提升。建议未来研究聚焦于:建立中国人ABO基因多态性数据库,开发纳米材料增强的快速检测芯片,探索抗体亲和力成熟调控通路。
血型系统的复杂性要求我们建立多维度认知体系。从兰茨泰纳的凝集观察,到当今的分子诊断技术,抗B抗体研究始终推动着输血医学进步。在精准医疗时代,只有将传统血清学与基因组学、蛋白质组学深度整合,才能实现从血型匹配到个体化输血的跨越式发展。这不仅关乎技术创新,更体现对生命奥秘的永恒探索。


