血液是人类生命活动的重要载体,而血型作为个体独特的生物学标识,在输血安全、器官移植、法医学等领域具有不可替代的作用。ABO血型系统作为最经典的红细胞抗原分类体系,其鉴定方法经过百年发展已形成标准化流程;而Rh血型系统中的RhD抗原分型(即“+”或“-”)则决定了血液的免疫相容性。以A型血为例,其亚型(A+或A-)的准确鉴定不仅关乎临床治疗的安全性,更可能影响稀有血型库的储备策略。

ABO血型鉴定的核心原理
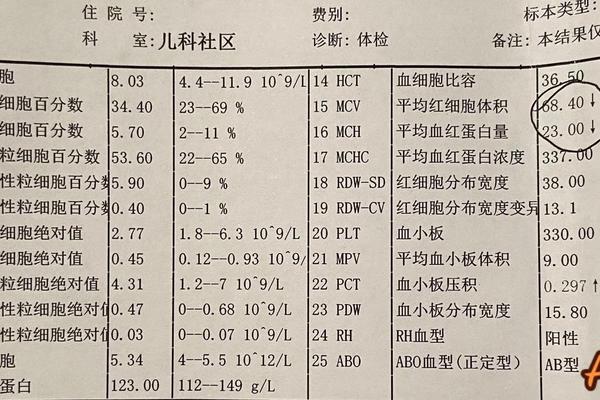
ABO血型系统基于红细胞表面A、B抗原的存在与否进行分类。对于A型血的确认,需通过正反定型双重验证:正定型检测红细胞抗原,使用标准抗A血清观察凝集反应;反定型则检测血清中的天然抗体,通过A、B、O型标准红细胞与待测血清反应,验证是否存在抗B抗体。例如,当抗A血清与红细胞发生凝集,而抗B血清未凝集时,可初步判定为A型。
反定型中的“4”通常指检测系统的四组对照(抗A、抗B、A细胞、B细胞)。若A型血反定型结果异常(如血清与A型红细胞发生凝集),可能提示亚型变异、自身抗体干扰或技术操作失误。例如,老年患者或免疫缺陷者可能出现抗体效价降低,需通过增加血清量或低温孵育增强反应强度。
RhD抗原分型的技术路径
Rh血型系统中,D抗原的存在与否直接决定“+”或“-”的分型。A+血型的确认需在ABO定型基础上,使用抗D试剂进行额外检测。常规玻片法中,抗D试剂与红细胞混合后若形成凝集,则判定为Rh阳性(A+),反之则为Rh阴性(A-)。此过程需注意假阴性风险:部分弱D抗原需通过间接抗人球蛋白试验(IAT)增强敏感性。
对于新生儿或孕妇,RhD分型需特别谨慎。母婴Rh血型不合可能引发新生儿溶血病,因此需采用分子生物学方法(如PCR-SSP)检测胎儿DNA中的RHD基因。研究表明,约0.2%的“Rh阴性”个体实际携带弱D变异体,此类案例需通过基因测序明确分型。
正反定型矛盾的解决方案
当ABO正反定型结果不一致时,需系统性排查技术误差与生物学干扰。以A型血为例,冷凝集素可能掩盖真实抗原表达。此时可通过37℃生理盐水洗涤红细胞3次,去除表面吸附的冷抗体;血清中的纤维蛋白原干扰则需延长凝血时间或稀释血清后复检。
另一常见问题是自身免疫性溶血性贫血(AIHA)患者的红细胞被抗体包裹。对此,56℃热放散技术可移除红细胞表面抗体,恢复其天然抗原性。临床案例显示,经放散处理后的A型红细胞与抗A试剂凝集强度可提升2个等级,显著提高判读准确性。
技术优化与临床挑战
自动化微柱凝胶技术的发展极大提升了血型检测效率。以卡式法为例,其将红细胞与试剂在凝胶介质中反应,通过离心分离凝集与非凝集细胞,较传统玻片法灵敏度提高10倍。但该方法对操作环境(如温度、离心参数)要求严格,需定期校准设备以规避假阳性风险。
稀有血型库的建立为A-等阴性血型患者提供了生命保障。统计显示,我国汉族人群Rh阴性比例不足0.3%,且地域分布差异显著。通过建立区域性稀有血型冰冻红细胞库,并采用核酸扩增技术(NAT)进行抗原谱筛查,可缩短紧急用血调配时间。
血型鉴定是一项融合免疫学、分子生物学与临床医学的精密技术。从A型血的正反定型到RhD抗原的分型,每一步骤均需严格遵循标准化流程,并结合个体化因素(如年龄、疾病状态)进行结果解读。未来研究可聚焦于以下方向:一是开发高灵敏度纳米材料抗体探针,实现微量样本的快速检测;二是构建基于人工智能的血型数据库,通过机器学习预测罕见血型变异;三是探索基因编辑技术在通用血型红细胞制备中的应用,从根本上解决血源短缺问题。唯有技术创新与临床实践深度融合,才能为精准医疗时代的血液安全提供坚实保障。


