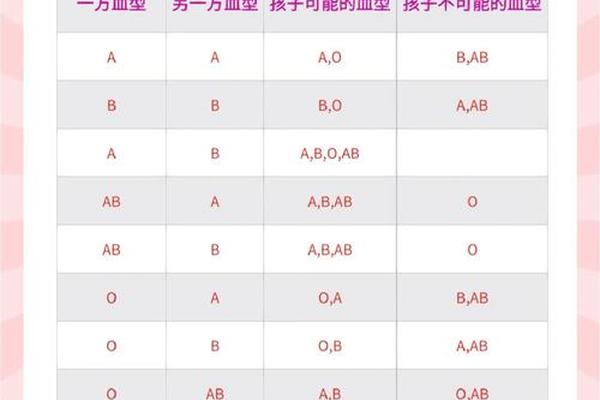
血型分布的差异本质上源于基因遗传的数学规律。ABO血型系统由A、B、O三个等位基因控制,其中A和B为显性基因,O为隐性基因。个体的血型表现由其基因型组合决定:AA或AO表现为A型,BB或BO表现为B型,AB型需同时携带A和B基因,而OO则表现为O型。由于每个个体仅能遗传父母各一个等位基因,“AAA”这样的三显性基因组合在常规遗传中根本不存在——这直接导致此类血型无法通过自然遗传产生。
从生物学角度看,人类是二倍体生物,同一基因位点最多只能携带两个等位基因。所谓“AAA血型”的提法本身存在概念性矛盾,因为基因型最多表现为AA(纯合显性)或AO(杂合显性)。即便在极少数基因突变案例中,例如染色体三体综合征患者可能携带三个A基因,其红细胞表面抗原仍表现为A型,而非独立的“AAA”分类。这解释了为何医学文献中从未将“AAA”列为独立血型类别。
二、抗原合成的生物屏障
血型抗原的形成需要特定分子结构的精确组装。A抗原的合成依赖于H物质在A酶催化下转化为N-乙酰半乳糖胺,而H物质本身的生成又受H基因控制。若H基因突变导致H物质缺失,即便携带A基因也无法合成A抗原,表现为“伪O型”。这种分子层面的限制使得A抗原的表达存在天然门槛。
从进化视角观察,A抗原的出现晚于O型。德国学者F.贝尔斯泰的研究指出,原始人类仅有O型血,A和B型是在约500万年前的基因突变中逐渐分化形成。这种进化时序导致A型抗原的分布频率本就低于O型。根据全球血型分布统计,A型约占40%-45%,而O型高达45%-50%,在非洲某些地区O型占比甚至超过60%。进化压力更倾向于保留基础型血型,这进一步限制了A型亚种的特殊变异。
三、检测技术的认知局限
常规血型鉴定主要依赖抗原抗体凝集反应,但某些特殊状况可能造成误判。例如白血病患者的A抗原可能暂时减弱,导致A型被误检为O型;肠胃疾病患者可能因获得性“类B抗原”干扰检测,使A型呈现AB型假象。这些技术局限使得部分A型亚种的细微差异难以被常规手段识别。
现代分子生物学虽能通过基因测序发现罕见变异,但临床实践中仍需遵循ABO系统的基本框架。2017年《现代生物医学发展》期刊记录的案例显示,某家庭因CisAB型血遗传导致亲子血型“异常”,但最终仍归入AB型分类体系。这说明医学界对血型变异采取谨慎的分类原则,避免因过度细分造成临床混乱。
四、地域与种族的分布差异
血型频率的分布呈现显著地域特征。北欧国家如挪威、芬兰的A型占比超过45%,而日本A型约占38%,我国北方汉族A型约31%,南方则降至27%。这种差异与病原体选择压力相关——A抗原对某些地域性传染病(如天花)的易感性差异,导致自然选择对不同血型频率产生调节作用。
在少数族群中发现的特殊变异更凸显环境适应性。美洲土著O型占比达90%,而北极因纽特人B型较高,这些极端分布表明,血型频率实则是基因与环境长期博弈的结果。在这种宏观选择压力下,A型内部的亚种分化难以获得足够的进化优势形成独立血型类别。
血型系统的复杂性远超常人想象,所谓的“AAA血型”更多是公众对专业概念的误读。从遗传机制、分子结构到检测技术,多重限制共同决定了血型分类的稳定性。当前研究应聚焦于完善血型变异的临床识别标准,例如建立H基因突变数据库,开发高灵敏度抗原检测试剂盒。未来或可通过单细胞测序技术揭示红细胞表面抗原的微观异质性,为精准输血和疾病诊疗开辟新路径。理解血型分布的本质规律,不仅关乎医学进步,更是解码人类进化史的重要钥匙。


