血液的相容性是现代医学的重要基石,但人类对血型系统的认知仍存在许多误区。当人们谈论血型混合时,常将ABO血型与Rh血型系统混淆,甚至出现"A型与D型混合"这类表述。实际上,D抗原属于Rh血型系统的重要标志,而ABO系统中的血型由A、B抗原决定。这种认知偏差可能源于公众对复杂血型系统的不完全理解,而深究不同血型混合的机制与后果,对临床输血安全、器官移植等领域具有重大现实意义。
血型系统的本质差异
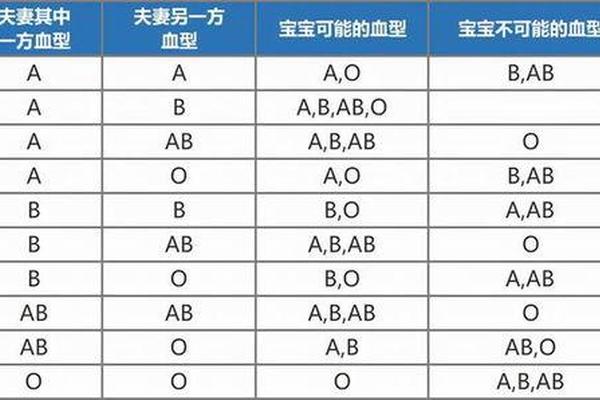
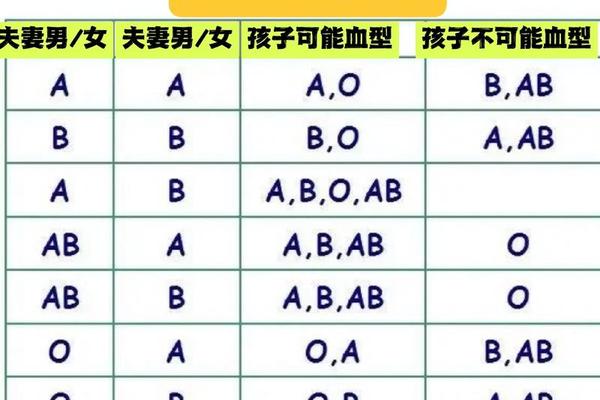
ABO血型系统与Rh血型系统分属不同的遗传体系。ABO血型由第9号染色体上的三个等位基因(A、B、O)控制,决定红细胞表面是否存在A或B抗原。A型血的红细胞携带A抗原,血清中含抗B抗体;B型血携带B抗原,血清含抗A抗体;AB型同时具有两种抗原而无相应抗体;O型则无A、B抗原但含有抗A和抗B抗体。Rh血型系统则涉及50多种抗原,其中D抗原的存在与否将血液分为Rh阳性或阴性。所谓的"D型血"实际上是指RhD抗原阳性,而非独立存在的血型系统。
这两个系统的遗传机制完全独立。ABO血型遵循显性遗传规律,父母血型组合决定子女可能的血型。例如A型(AA或AO)与O型(OO)父母只能生育A型或O型子女。而Rh血型中,若母亲为Rh阴性(dd),父亲为Rh阳性(DD或Dd),胎儿可能继承显性D基因导致母体产生抗D抗体,引发新生儿溶血。这种遗传独立性意味着,血型描述必须同时包含ABO与Rh两个系统的信息,如"A型Rh阳性"或"O型Rh阴性"。
血型混合的医学风险
在输血实践中,ABO与Rh血型的不匹配都会引发致命后果。当A型血输入B型受血者体内,受血者血清中的抗A抗体立即与供血红细胞的A抗原结合,激活补体系统导致红细胞溶解。这种急性溶血反应可在数分钟内引发休克、肾衰竭甚至死亡。Rh阴性个体首次输入Rh阳性血液时,虽因缺乏抗D抗体不会立即溶血,但会产生免疫记忆。二次输血时,大量抗D抗体的出现将导致迟发性溶血反应,死亡率高达30%。
实验室研究揭示了血型抗体的作用机制。抗A、抗B抗体属于IgM型免疫球蛋白,能直接激活补体系统引发血管内溶血;而抗D抗体多为IgG型,通过单核-巨噬细胞系统引发血管外溶血。这种差异解释了为何ABO血型不合会立即出现血红蛋白尿,而Rh血型不合的严重反应常在输血后数日显现。最新数据显示,我国临床输血反应中ABO血型错误占比62%,Rh血型错误占28%,凸显精准配血的重要性。
血型转换的科学突破
针对血型不兼容难题,科学家正探索生物酶转化技术。2024年丹麦技术大学的研究团队从嗜黏蛋白阿克曼菌中分离出新型酶组合,可高效切除A、B抗原的末端糖基,将A/B型红细胞转化为O型。实验显示,0.5μM浓度的AmGH36A酶能在30分钟内完全清除A型抗原,转化效率较传统酶提高200倍。这种技术突破意味着未来或能建立"通用血库",将任意血型转化为O型Rh阴性"万能血",缓解稀有血型供应危机。
基因编辑技术为血型改造提供新思路。通过CRISPR-Cas9敲除ABO基因或插入O型等位基因,可在造血干细胞层面实现血型永久转换。2022年剑桥大学团队成功将捐赠肾脏的血管内皮细胞ABO抗原表达沉默,使器官适应任何血型受者。这类技术突破不仅提高输血安全,更为器官移植开辟新可能。但生物工程血液的长期安全性仍需验证,例如酶处理是否改变红细胞膜稳定性,基因编辑是否诱发基因组脱靶效应等。
临床实践的应对策略
建立精准输血体系是当前医疗系统的首要任务。三级医院已普及电子交叉配血技术,将传统2小时的配血时间缩短至15分钟,准确率达99.99%。对于Rh阴性患者,自体血回输技术可将术中出血经处理后回输,避免异体输血风险。统计显示,采用该技术后,Rh阴性孕产妇死亡率下降76%。在偏远地区,无人机血液运输网络的建设使稀有血型配送时效提升80%,挽救了许多创伤患者的生命。
公众教育同样不可或缺。调查显示,仅38%的民众能正确区分ABO与Rh血型系统,23%的人误认为"父母血型相同子女必同型"。医疗机构通过虚拟现实技术模拟溶血反应过程,使献血者直观理解血型匹配的重要性。某血液中心的实践表明,接受过VR教育的献血者重复献血率提高41%,血型认知准确率提升至89%。这种沉浸式教育模式正在全球推广。
血型系统的复杂性既是生命进化的智慧结晶,也是医学面临的持久挑战。从酶转化技术到基因编辑,科学突破正在重塑血液医疗的格局,但技术的应用必须建立在严谨的风险评估之上。未来研究应聚焦于转化血液的长期稳定性、新型血型抗原的发现以及个性化输血方案的制定。对公众而言,了解基础血型知识、定期参与献血,既是公民责任的体现,也为推动血液科学发展贡献力量。当科技与人文共同进步,人类终将破解血液相容性的终极密码。


