血液是人类生命活动的重要载体,而血型系统的多样性决定了输血医学的复杂性。在ABO血型之外,Rh血型系统的临床意义尤为突出。当人们谈论“熊猫血”时,往往联想到Rh阴性血型,然而这一概念常与ABO血型中的具体类别产生混淆。例如,A型Rh阳性是否属于“熊猫血”?这一问题背后,不仅涉及血型分类的科学定义,更关乎临床输血安全与稀有血型群体的生存权益。本文将从多个维度剖析Rh阴性血型的本质,并探讨其在现代医学中的特殊意义。
血型系统的双重分类
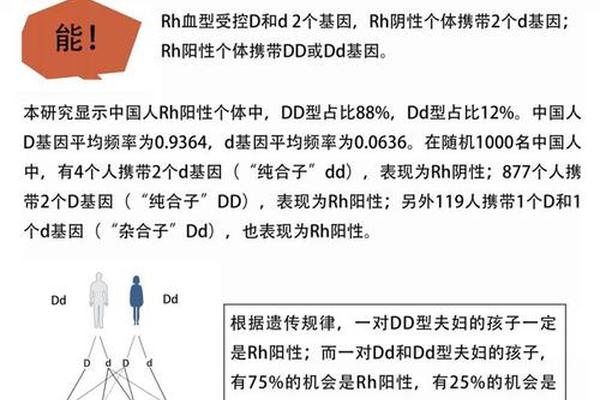
人类血型由ABO和Rh两大系统共同决定。ABO系统根据红细胞表面A、B抗原的存在划分为A、B、AB、O四种类型,而Rh系统则以D抗原为标志,将人群分为Rh阳性(约99%中国人群)与Rh阴性(仅占0.3%-0.5%)。这两个系统相互独立,因此血型的完整表述需包含ABO型与Rh型的组合。例如“A型Rh阳性”表示该个体在ABO系统中为A型,同时携带Rh系统的D抗原。
“熊猫血”特指Rh阴性血型,与ABO系统中的具体类别无关。无论ABO型是A、B、AB或O,只要Rh检测为阴性,即属于稀有血型范畴。这种双重分类机制解释了为何A型Rh阳性并非熊猫血——其D抗原的存在使其成为Rh阳性群体中的普通一员,与稀有性无关。
遗传机制与族群分布
Rh血型的遗传遵循孟德尔定律。D抗原由位于1号染色体的RHD基因控制,当个体携带至少一个功能性RHD等位基因时表现为Rh阳性,而纯合隐性突变(无功能性RHD基因)则导致Rh阴性。中国汉族人群中,Rh阴性基因频率不足1%,远低于白种人的15%,这使得Rh阴性血型在亚洲更具稀缺性。
值得注意的是,Rh阴性中存在特殊亚型——亚洲型DEL。这类个体的红细胞表面D抗原表达极微弱,常规检测易被误判为Rh阴性,但最新研究表明其输血时可安全接受Rh阳性血液,这为优化稀有血型管理提供了新思路。基因检测技术的进步正逐步揭示Rh血型系统的复杂性,2020年浙江大学团队更通过细胞膜工程构建人工通用熊猫血,展现了基因编辑在血源短缺问题上的应用潜力。

临床输血的核心挑战
Rh阴性患者接受Rh阳性血液时,首次输血可能诱发抗D抗体生成,再次输入将引发致命性溶血反应。这种免疫记忆机制使得Rh阴性群体面临双重困境:日常需避免接触Rh阳性血液,紧急用血时又面临库存不足的危机。据统计,中国每年有上万例Rh阴性孕产妇,其中大出血抢救案例对血源时效性要求极高。
为应对这一挑战,医疗机构建立了两级保障体系:一是将部分Rh阴性红细胞低温冻存,通过洗涤解冻技术实现快速供应;二是组建稀有血型志愿者联盟,通过精准招募保障应急血源。例如上海市建立的Rh阴性血型数据库,可在4小时内完成稀有血型匹配,显著提升了救治成功率。
社会支持与责任
稀有血型群体自发形成的互助网络,成为医疗体系的重要补充。湖南廖姓献血者71次捐献Rh阴性血的案例,彰显了“熊猫侠”群体的社会责任。但调查显示,仅有35%的Rh阴性人群定期参与献血,血站仍高度依赖街头随机采集。这种被动供给模式导致库存波动明显,2022年北京血液中心Rh阴性血缺口高峰期达30%。
争议聚焦于血液商品化问题。部分地区的Rh阴性血液定价偏高,可能加剧医疗资源分配不公。学界呼吁建立国家层面的稀有血型保障基金,通过财政补贴消除价格差异,同时加强基因数据库建设,实现对Rh阴性人群的动态健康管理。
未来研究与技术突破
在基础研究领域,Rh血型抗原的分子机制仍是热点。2023年《血液学前沿》刊文指出,D抗原的三维构象差异可能影响抗体结合效率,这为开发新型血型鉴定试剂提供了理论依据。临床转化方面,浙江大学研发的聚唾液酸凝胶网络技术,通过掩蔽RhD抗原成功实现Rh阳性红细胞的安全转化,动物实验显示其循环半衰期与天然红细胞无差异。
基因编辑技术为根治血型不合提供了新可能。CRISPR-Cas9介导的RHD基因修复已在体外实验中实现Rh阴性向阳性转化,但审查与脱靶效应仍是产业化障碍。群体遗传学研究则提示,通过区域性婚育指导降低Rh阴性胎儿出生率,可作为预防新生儿溶血的补充策略。
Rh阴性血型作为生命科学领域的特殊坐标,既揭示了人类遗传的多样性,也暴露出医疗体系的脆弱性。明确“A型Rh阳性非熊猫血”的认知,有助于公众理解血型系统的科学内涵。面对0.3%的稀有群体,需要构建涵盖基因检测、冷冻保存、人工合成等多维度的血液保障网络。未来研究应聚焦于DEL亚型的临床转化、通用型人工血液开发以及基因治疗技术的安全性评估,最终实现“每个生命都能获得匹配的血液”这一终极愿景。


