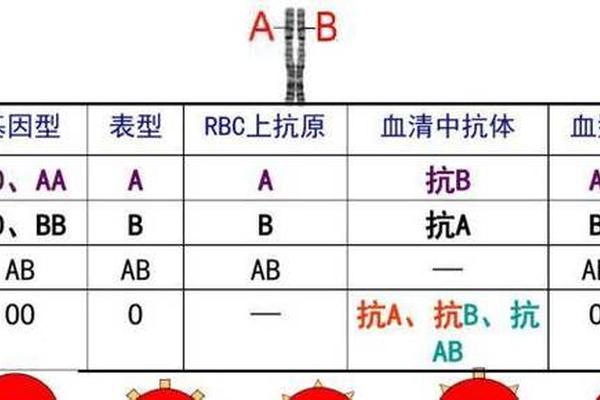
A型血的核心特征在于红细胞表面携带的A抗原,其本质是糖蛋白复合物。ABO血型系统的基础在于红细胞膜表面寡糖链末端的糖基化修饰差异:A抗原由N-乙酰半乳糖胺通过α-1,3糖苷键连接到H抗原前体(岩藻糖基化的乳糖核心结构)形成。这种糖基转移酶由位于第9号染色体上的ABO基因A等位基因编码,催化特异性糖基的添加过程。
H抗原作为A、B抗原的共同前体,其存在是ABO系统的基础。孟买血型个体的红细胞由于缺乏H抗原,即使携带A或B基因也无法表达相应抗原,表现为O型特征。在A型血中,H抗原的岩藻糖基化水平低于O型血,这与其糖基转移酶活性差异直接相关。研究发现,A型转移酶活性强的个体,其红细胞表面的A抗原密度更高,抗原性也更显著。
二、A型亚型的抗原差异与检测挑战
临床发现的A型亚型多达十余种,最常见的是A1和A2亚型。A1型红细胞同时表达A和A1抗原,而A2型仅表达A抗原,两者的差异源于糖基转移酶活性的分子机制差异。A1转移酶能够催化形成3型A抗原结构,而A2转移酶仅能生成2型A抗原,这种结构差异导致A2型红细胞的抗原位点数仅为A1型的1/4-1/3。
这种抗原密度的显著差异给临床检测带来挑战。常规抗A试剂可能无法有效识别A2型红细胞,特别是在混合视野凝集的情况下,A3型等弱亚型容易误判为O型。研究显示,我国汉族人群中A2亚型仅占A型群体的1%以下,但在输血实践中仍需通过吸收放散试验、唾液血型物质检测等补充方法进行鉴别。2017年某医院曾发生因A型患者出现类B抗原干扰导致误定为AB型的案例,最终通过37℃洗涤红细胞排除了获得性抗原干扰。
三、抗原表达的临床意义与免疫反应
在输血医学中,A抗原的准确识别关乎生命安危。当A型血误输给B型受血者时,受血者血清中的抗A抗体将引发补体介导的溶血反应,这种免疫应答可在数分钟内导致血红蛋白尿、肾衰竭等严重并发症。统计显示,ABO血型不合输血导致的急性溶血反应死亡率可达20%。
近年研究发现,A抗原的表达强度与疾病易感性存在关联。胃癌患者中A型血比例显著高于其他血型,可能与A抗原促进幽门螺杆菌定植相关。在心血管疾病领域,A型血个体的凝血因子VIII水平较高,血栓形成风险较O型血增加20-30%。这些发现推动了个体化医疗中血型参数的临床应用拓展。

四、遗传机制与分子生物学进展
A型血的遗传遵循孟德尔显性规律,基因型为AA或AO的个体均表现为A型。ABO基因的7号外显子单核苷酸多态性(SNP)决定糖基转移酶特异性,其中261位点的G→A突变使酶获得N-乙酰半乳糖胺转移能力,从而产生A抗原。基因测序技术已能精准识别包括cisAB、B(A)等稀有变异型,某研究团队通过二代测序发现中国人群特有的ABOAW.31等位基因。
2024年丹麦技术大学的突破性研究显示,从嗜黏蛋白阿克曼菌中提取的酶组合可将A型血转化为通用O型,该技术通过特异性切除A抗原末端的N-乙酰半乳糖胺,使转化后的红细胞不再引发免疫排斥。这种酶处理技术已在体外试验中实现A2型红细胞100%转化率,为缓解血源紧张提供了新思路。
五、未来研究方向与技术革新
随着单细胞测序技术的发展,科学家正深入解析A抗原表达的时空异质性。初步研究表明,红细胞发育过程中ABO基因的甲基化修饰会影响抗原表达强度,这为体外定向培育通用血型红细胞提供了理论依据。在疾病治疗领域,基于A抗原结构的靶向药物递送系统正在研发中,利用其与特定凝集素的结合特性实现精准给药。
血型抗原的合成生物学研究也取得进展。2023年上海团队成功在酵母体系中重构A抗原合成通路,这种人工抗原可用于制备高灵敏度诊断试剂。而基于CRISPR-Cas9的基因编辑技术,已在动物模型中实现ABO基因的定向改造,为根治新生儿溶血病开辟了新途径。
A型血的核心抗原特征既承载着生命进化的密码,又牵动着现代医学的发展脉搏。从输血安全的精准把控到疾病机制的深度解析,从基因编辑的技术突破到合成生物学的创新应用,对A抗原的持续研究不断拓展着人类对生命本质的认知边界。未来,随着多组学技术的融合发展和跨学科研究的深入推进,A型血抗原系统将在个体化医疗、应急输血、疫苗开发等领域发挥更关键的作用,持续为人类健康事业注入新的科学动能。


