血液的奥秘蕴藏在红细胞表面微小的抗原差异中,而抗A血型试剂作为一把精准的“分子钥匙”,通过凝集反应揭示了ABO血型系统的核心机制。当抗A试剂与受检者红细胞发生凝集时,意味着红细胞表面存在A抗原,对应血型为A型或AB型。这张看似简单的ABO血型鉴定示意图,实则凝结了百余年医学研究的智慧结晶,其背后涉及免疫学、遗传学与临床医学的深度交织。本文将从分子机制到临床应用,系统解析这一生命密码的破译过程。
抗原抗体反应的分子机制
ABO血型系统的核心在于红细胞膜表面的糖蛋白抗原结构差异。A型抗原由N-乙酰半乳糖胺通过α-1,3糖苷键连接在H抗原前体物质上形成,B型抗原则通过α-1,3糖苷键连接半乳糖。抗A试剂中的人源化单克隆抗体能够特异性识别这种独特的糖基化修饰,当遇到A抗原时,抗体的Fab段与抗原表位结合,Fc段则引发补体级联反应,导致红细胞交联形成肉眼可见的凝集块。
这种特异性识别具有极高的灵敏度,实验数据显示,优质抗A试剂的凝集反应在15秒内即可显现,效价要求达到1:128以上,且对B型、O型红细胞完全无交叉反应。但抗原表达的弱变异可能影响检测结果,如A亚型中的A2型抗原位点密度仅为A1型的1/4,此时需要延长反应时间至30分钟或采用增强介质。
检测方法的演进与优化
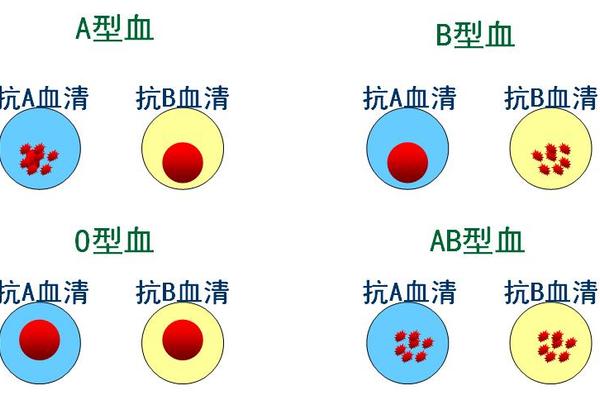
从传统的玻片法到现代微柱凝胶技术,ABO血型鉴定方法经历了三次技术革新。玻片法作为经典方法,通过抗A、抗B试剂分区点样,凭借操作简便、成本低廉的优势,至今仍是基层医疗机构的首选。但其存在反应时间长(需10-15分钟)、灵敏度低的缺陷,对低效价样本易出现假阴性。
试管离心法通过1000rpm离心1分钟的物理加速,使检测时间缩短至3分钟内,同时增强弱抗原的凝集强度,特别适用于新生儿及老年患者的血型鉴定。而微柱凝胶法则将反应体系标准化,通过凝胶介质过滤未凝集细胞,配合自动化判读系统,使检测灵敏度提升至0.1%抗原浓度差异水平。
质量控制的关键要素
试剂质量直接影响检测准确性。我国药典规定抗A试剂需满足四项核心指标:效价≥1:128、亲和力≤15秒、特异性100%、冷凝集效价≤1:4。实验发现,储存温度波动超过2-8℃范围会导致抗体活性每周下降约5%,故需严格冷链运输。对于特殊样本,如自身冷凝集素阳性者,需用37℃生理盐水洗涤红细胞3次以排除干扰。
室内质控需每日进行已知血型验证,研究显示,采用A2、B3型质控细胞可检出90%以上的试剂性能异常。交叉配血试验作为最后防线,能发现0.01%的血型不配合情况,在紧急输血时应同时进行主侧、次侧配型。
临床误判的病理机制
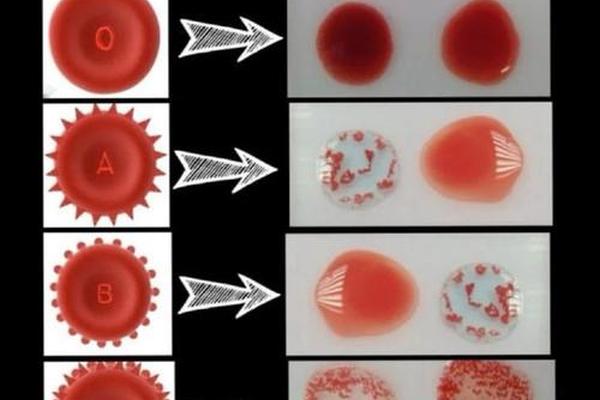
约0.3%的血型误判源于病理性干扰。白血病患者可能出现ABO抗原减弱现象,研究显示急性髓系白血病患者中7.2%出现血型抗原表达量下降50%以上。造血干细胞移植后形成的嵌合体状态,需通过流式细胞术检测供受体细胞比例,当供体细胞占比>95%时才可判定血型转换完成。
新生儿血型鉴定需特别注意被动获得抗体问题,母体IgG型抗A/B抗体可通过胎盘,导致反向定型失效。此时应采用酸解离法去除IgG干扰,或延迟至6月龄后复查。对于ABO血型不合的器官移植,术前需进行血浆置换使抗体效价降至1:8以下,配合免疫抑制剂可提高移植物存活率。
未来发展方向
基因分型技术的突破为血型鉴定带来新维度。焦磷酸测序可检出99.9%的ABO等位基因变异,对CisAB、B(A)等稀有血型的鉴别准确率高达100%。纳米材料标记技术的应用使检测灵敏度提升至单细胞水平,金纳米颗粒标记的抗A抗体可实现肉眼判读的即时检测(POCT)。人工智能图像分析系统通过深度学习凝集模式,使判读一致性从人工的85%提升至98%。
在临床输血医学迈入精准时代的今天,ABO血型鉴定已从简单的凝集观察发展为多维度、多模态的检测体系。抗A试剂与血型示意图所承载的不仅是免疫反应的微观世界,更是保障输血安全、推动移植医学发展的基石。未来随着分子诊断与生物信息学的深度融合,血型检测将突破现有技术边界,在个体化医疗中发挥更重要的作用。


