A3亚型属于ABO血型系统中罕见的A亚型分支,其本质是ABO基因发生特异性突变导致A抗原表达减弱。根据江苏省血液中心的研究,A3亚型的形成与ABO基因第7外显子1054位点碱基缺失或启动子区域-119位C>T突变直接相关。这类突变会改变糖基转移酶活性区域的氨基酸序列,使酶催化A抗原合成的效率显著降低,最终表现为红细胞表面A抗原密度仅为正常A型血的1/10至1/50。
一项针对20例ABO抗原异常样本的基因测序发现,约15%的案例存在启动子区域-35_-18位的碱基缺失,这种突变会干扰基因转录调控机制,导致抗原合成受阻。南京医科大学附属儿童医院的研究还发现,部分A3亚型患者同时携带ABOB.01或ABOO01.01等复合基因型,进一步增加了血型鉴定的复杂性。这些分子机制的揭示为临床精准分型提供了理论基础。
二、血清学特征与鉴定挑战
A3亚型的血清学特征具有显著特殊性。在正定型检测中,抗A试剂通常仅引发弱凝集或混合视野凝集现象,例如某案例显示抗A效价仅为1:8(正常A型应≥1:128),且凝集强度随反应时间延长而减弱。反定型时,患者血清中可能同时存在抗A1抗体,导致与A1型标准红细胞的凝集反应异常。
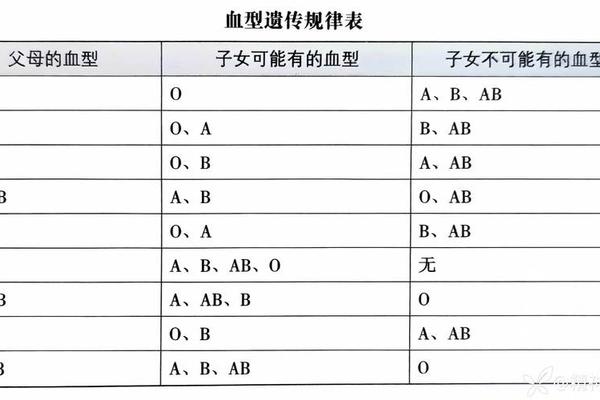
鉴定A3亚型需采用多重技术联用策略。传统盐水试管法需配合抗H试剂检测,因A3红细胞表面H抗原残留量高于正常A型;而微柱凝集法则需延长孵育时间至30分钟以提高灵敏度。例如佛山某医院通过抗-H实验与亲和力实验(凝集时间差异达5倍)成功鉴别出A3亚型,其亲和力实验凝集时间平均为32秒,显著长于正常A型的6秒。这些特殊检测流程的建立有效避免了将A3误判为O型的风险。
三、临床意义与输血安全
A3亚型的临床管理面临双重挑战。一方面,患者作为受血者时,若误判为O型而输注O型血,可能因残留A抗原引发溶血反应。研究显示,A3抗原虽弱但仍可被高效价抗A抗体识别,在抗体效价≥1:64的O型血浆中,溶血发生率可达12%。作为献血者时,其血液中的微弱A抗原可能刺激受血者产生免疫记忆,导致后续输血反应风险升高。
国际输血协会建议对疑似A3亚型实施三级确认流程:包括血清学复核、家系调查及基因测序。我国《临床输血技术规范》特别强调,对于正反定型不符的样本,必须加做吸收放散试验和分子生物学检测。某三甲医院统计显示,采用该流程后,A亚型误判率从2.1%降至0.3%。这种严格的质量控制体系显著提升了输血安全性。
四、检测技术创新与展望
当前A3亚型检测已进入多组学融合时代。传统血清学方法结合基因测序技术(如Sanger测序、NGS)可精准识别ABO基因的SNP位点及结构变异。深圳先进技术研究院开发的合成生物学检测平台,通过构建人工抗原-抗体反应系统,将检测灵敏度提升至10^3抗原分子/红细胞,较传统方法提高两个数量级。
未来研究需重点关注三个方向:一是建立中国人A亚型基因突变谱数据库,目前已知的36种ABO亚型中,汉族人群特有的突变类型尚未完全阐明;二是开发便携式快速检测设备,某团队设计的微流控芯片可在15分钟内完成ABO基因分型,适合基层医院推广;三是探索基因编辑技术在稀有血型红细胞体外培养中的应用,日本已成功利用iPS细胞制备功能性A3型红细胞,为自体输血提供新思路。
总结与建议
A3亚型的深入研究揭示了人类血型系统的复杂演化机制。从分子诊断到临床输血,每个环节都需要精准医学理念的贯彻。建议医疗机构:①建立区域性稀有血型应急网络,实现检测资源共享;②加强检验人员专项培训,将ABO亚型鉴定纳入质控考核;③推动多中心研究合作,完善中国人群血型基因多态性图谱。随着合成生物学与基因测序技术的融合,未来有望实现从"血型匹配"到"抗原定制"的跨越式发展,从根本上解决稀有血型患者的输血困境。


