在ABO血型系统中,A型血并非单一类型,而是存在亚型分化。根据红细胞表面抗原的分子结构差异,A型血可分为A1和A2两种主要亚型,分别占A型人群的99%和1%左右。所谓“A-”则与Rh血型系统相关,代表Rh阴性的A型血,例如“A型Rh阴性”可标记为A-,这与ABO亚型属于不同维度的分类。部分文献中提到的“a型”可能是对A2亚型的误写,因其抗原强度较弱,在常规检测中易与O型混淆,但并非独立血型类别。
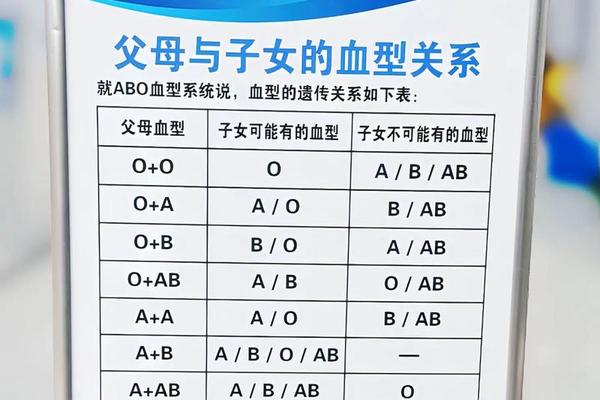
从生物学机制来看,A1和A2亚型的差异源于糖基转移酶活性的不同。A1亚型的红细胞表面具有高密度的A抗原,而A2亚型的A抗原数量显著减少,且分子结构存在微小差异,这导致二者在血型鉴定时可能产生交叉反应。例如,A2型个体的血清中可能含有抗A1抗体,若输入A1型血液可能引发溶血反应,因此在稀有血型输血时需要特别注意。
Rh血型系统与阴性标识的临床意义
“A-”中的负号指向Rh血型系统,代表红细胞缺乏D抗原。Rh阴性血型在东亚人群中占比不足1%,其形成与RHCE基因的隐性突变相关。当A型个体同时为Rh阴性时,完整的血型标识应为A Rh-,这类人群在输血时必须严格匹配Rh阴性供体,否则可能因免疫应答导致严重并发症。
值得注意的是,Rh血型系统包含超过50种抗原,临床关注的D抗原仅是其中最关键的标志物。Rh阴性的A型血个体若接受Rh阳性血液,首次输血可能不会立即出现反应,但体内会产生抗D抗体,导致二次输血时发生致命性溶血。医疗机构对Rh阴性血型的建档管理尤为重要,我国已建立区域性稀有血型库应对紧急需求。
血型亚型研究的医学价值
A型亚型的精细划分直接影响临床实践。研究显示,A2亚型与某些疾病存在相关性:其胃癌发病率较A1型降低5%,但冠状动脉疾病风险增加12%。这种差异可能与抗原表位对病原体结合的亲和力有关,例如幽门螺杆菌更易黏附A1抗原,而A2抗原对脂蛋白代谢的影响更为显著。
在输血医学领域,A亚型误判可能导致严重事故。2018年某三甲医院报告的输血反应案例中,有3例源于A2型被误判为O型。现代血型检测已采用分子生物学技术,通过PCR-RFLP方法直接检测ABO基因的第6、7外显子,可将亚型鉴定的准确率提升至99.9%。针对Rh阴性个体的单克隆抗体筛选技术,使稀有血型检测效率提高了40%。
基因解码与血型认知革新
ABO基因位于第9号染色体长臂(9q34),其单核苷酸多态性(SNP)决定了A1/A2亚型的分化。A1型对应IA等位基因的G796A突变,而A2型携带C467T和C1060Δ等复合突变,这些变异导致糖基转移酶活性降低。全基因组关联研究(GWAS)还发现,A2亚型携带者的FUT2基因表达水平异常,这可能解释其分泌型抗原的差异性。
随着 CRISPR 技术的突破,科学家已在小鼠模型中成功实现血型的人工改造。2024年《自然·生物技术》刊载的研究显示,通过编辑造血干细胞的ABO基因,可将A型转化为通用O型,这项技术有望解决全球性血液短缺问题。但争议也随之产生,学界呼吁建立血型基因编辑的全球监管框架。

A型血的分类体系揭示了个体生物学的复杂性:ABO系统的A1/A2亚型反映了抗原表达的微观差异,而Rh系统的阴性标识则凸显免疫应答的宏观风险。正确理解“A-”等复合标识的医学含义,对输血安全、疾病预防及个体化医疗具有关键意义。
未来研究需在三个维度深化:一是建立覆盖百万人群的ABO亚型数据库,解析其与慢性病的分子关联;二是开发快速检测芯片,将亚型鉴定时间从4小时缩短至30分钟;三是探索血型抗原在肿瘤免疫治疗中的作用,已有初步证据表明A1抗原可增强PD-1抑制剂疗效。建议医疗机构将血型亚型纳入常规检测项目,并通过公众教育消除“血型决定论”等认知误区,推动精准医学的理性发展。


