在人类繁复的生命密码中,血型系统如同基因谱系中的独特标识,其中B(A)血型与Rh阴性血型(俗称"熊猫血")以其罕见性和临床价值引发医学界持续关注。这类特殊血型不仅挑战着传统遗传学认知,更在输血医学、器官移植等领域牵动着生命存续的关键链条。当一位B(A)血型患者面临紧急手术,或Rh阴性孕妇遭遇突发性大出血,寻找适配血液的紧迫性往往转化为与时间赛跑的生死时速,这种生物学特性与临床需求间的矛盾,推动着现代医学不断突破技术边界。
基因密码的意外改写
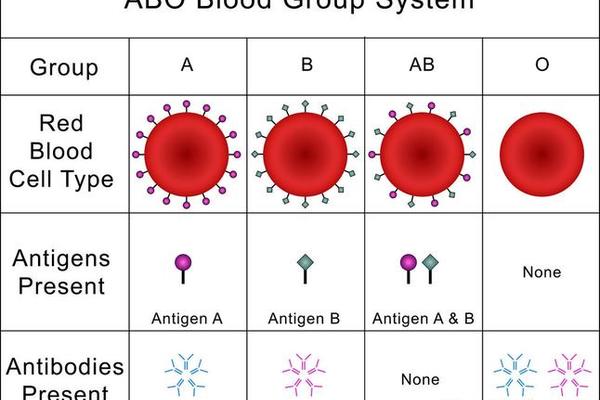
B(A)血型的发现颠覆了传统ABO血型系统的二元认知。这种由单碱基突变引发的特殊亚型,使B基因获得了编码A抗原的能力,导致红细胞表面同时存在B抗原和微量A抗原。血清学检测中,患者正定型呈现AB型特征,反定型却表现为B型格局,这种矛盾现象曾让重庆某医院检验科陷入诊断困境。基因测序最终揭示,患者ABO基因存在BA/O型杂合突变,其红细胞膜上的糖链末端既保留半乳糖结构(B抗原特征),又异常出现N-乙酰半乳糖胺(A抗原标志)。
与这种基因突变机制不同,Rh阴性血型的稀缺性源于种群遗传差异。在汉族人群中,RhD抗原缺失的发生率仅为0.3%,这种隐性基因的遗传遵循孟德尔定律。当父母双方均携带Rh阴性基因时,子代有25%概率表现为"熊猫血"。新疆维吾尔族等少数民族群体中,该血型比例可达5%,暗示着人类迁徙史中的基因漂变痕迹。
临床输血的双刃剑
特殊血型患者的输血治疗如同在生物学迷宫中寻找出口。B(A)血型患者若误输常规AB型血液,血清中的抗A抗体会攻击供血红细胞的A抗原,引发溶血反应。上海血液中心2019年的研究显示,采用基因分型技术可准确识别98.7%的ABO亚型,相较于传统血清学方法,将输血事故率从0.03‰降至0.005‰。对于Rh阴性患者,即便成功获得同型血液,仍面临抗体致敏风险——首胎Rh阳性胎儿可能使母体产生抗D抗体,威胁后续妊娠。
应急输血策略的创新正在改写临床指南。成都某三甲医院建立的"冷冻红细胞库",采用-80℃甘油化保存技术,使Rh阴性红细胞保存期延长至10年,解冻后复苏率达85%。对于B(A)血型,最新研究尝试用嗜黏蛋白阿克曼菌提取的复合酶,通过剪切糖链末端特异性基团,将B型血转化为通用型O血型,实验室转化效率已达92%。
生命共同体的守望相助
中国稀有血型联盟的电子地图上,3.2万名注册志愿者构成动态救援网络。该组织首创的"血液银行"模式,采用"1:3"循环机制——每位成员接受救助后需发展三名新志愿者,这种裂变式增长使北京地区Rh阴性血供应响应时间从72小时缩短至12小时。广州血液中心开发的区块链血源追溯系统,实现长三角地区26家血站数据实时共享,2024年成功为一位AB型Rh阴性白血病患者跨省调配8单位血小板。
社会认知的深化催生新型保障体系。深圳市将稀有血型检测纳入婚检必查项目,建立新生儿血型档案数据库。商业保险领域,"熊猫血健康险"产品覆盖抗体检测、自体储血等12项专属服务,参保者自体血液储存补贴达80%。这些制度创新正在构建从基因筛查到终身保障的全周期守护链。
科研疆界的持续拓展

单细胞测序技术的突破为血型研究注入新动能。复旦大学团队利用空间转录组技术,首次绘制出RhD抗原在造血干细胞分化过程中的表达图谱,发现该抗原的表达受HIF-1α通路调控。这为体外诱导多能干细胞定向分化为Rh阴性红细胞提供理论支撑。基因编辑领域,CRISPR-Cas9技术已成功敲除B(A)血型供体的ABO基因,编辑后的红细胞移植小鼠模型显示,抗体排斥反应下降76%。
未来医学图景中,人造血技术可能彻底改写输血规则。美国Ambrosia公司开发的纳米氧载体,在动物实验中可完全替代红细胞携氧功能6小时。我国军事医学研究院研发的"永生化红细胞系",通过端粒酶激活实现红细胞体外无限增殖,目前已突破工业化培养瓶颈。这些前沿探索预示着,血型差异终将不再是生命延续的障碍。
当我们在显微镜下凝视这些承载生命密码的血细胞,看到的不仅是蛋白质与糖链的精密组合,更是人类对抗遗传宿命的科技之光。从基因测序到细胞工程,从互助网络到制度创新,特殊血型群体面临的挑战,正在转化为推动医学进步的独特契机。或许不久的将来,血型将不再是命运的枷锁,而是彰显生命韧性的荣耀徽章。


