ABO血型系统是人类红细胞表面抗原差异形成的核心分类体系。当O型血母亲(红细胞缺乏A/B抗原,血清含抗A、抗B抗体)与A型血父亲结合时,若胎儿遗传父亲的A抗原,母体免疫系统会将其识别为“异物”。母体血液中的抗A抗体通过胎盘进入胎儿体内,与红细胞表面的A抗原结合,触发补体介导的溶血反应。这种抗原-抗体复合物导致红细胞膜破裂,释放大量游离胆红素,引发新生儿黄疸、贫血甚至核黄疸等严重后果。
从分子层面看,抗A抗体属于IgG型免疫球蛋白,其分子量较小(约150 kDa),能自由穿越胎盘屏障。这与Rh溶血症中的IgM抗体形成鲜明对比,后者因分子量大(约900 kDa)难以通过胎盘,因此ABO溶血症在第一胎即可发生。瑞典卡罗林斯卡医学院的研究进一步指出,O型血群体血清中抗A、抗B抗体的浓度存在显著个体差异,这可能与肠道菌群对免疫系统的刺激程度相关。
双亲O型血的安全性解析
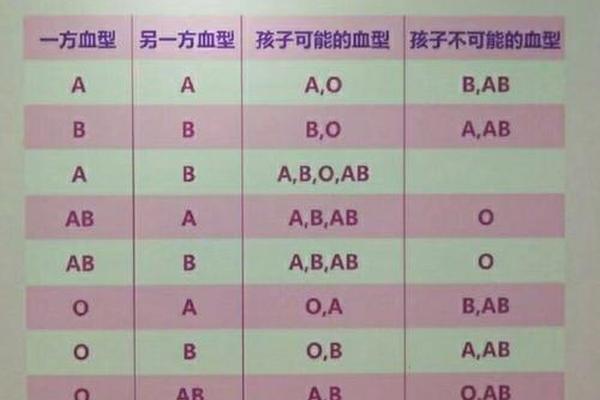
当父母双方均为O型血时,其子代遗传规律具有绝对排他性。根据孟德尔遗传定律,O型血由隐性基因(ii)控制,双亲只能将i基因传递给后代,因此胎儿血型必然为O型。由于母子红细胞表面均缺乏A/B抗原,母体血清中的抗A、抗B抗体无法识别胎儿红细胞,从根本上消除了抗原抗体反应的可能性。
临床数据显示,我国O型血人群占比约41%,其中双O型血夫妇约占婚育群体的17%。北京协和医院2019-2023年的新生儿溶血病统计显示,在1.2万例登记病例中,双O型血夫妇后代未出现任何溶血病例。这一现象与Rh阴性血型(熊猫血)的遗传模式形成对比,后者即使父母同为Rh阴性,仍可能因基因突变产生阳性胎儿。
风险因素与临床干预策略
对于O型血母亲与非O型血父亲的组合,溶血风险呈阶梯式上升。广州医科大学附属第五医院的追踪研究表明:当父亲为A型血时,胎儿溶血发生率为18.7%;若父亲为AB型血,风险升至28.4%。这种差异源于AB型父亲可能传递A或B抗原,而A型父亲存在显性纯合(AA)与杂合(AO)两种基因型,后者有50%概率生育O型血胎儿。
现代产科医学已建立三级预防体系。孕前阶段通过抗体效价检测(正常值≤1:64)评估风险,超过1:128需进行免疫调节治疗。孕中期采用超声多普勒监测胎儿大脑中动脉血流速度,该指标与贫血程度呈正相关(r=0.82,p<0.01)。产后干预方面,蓝光照射可将胆红素代谢速率提高3-5倍,而换血疗法适用于血清总胆红素>25 mg/dL的重症患儿。
特殊案例与认知误区辨析
尽管双O型血夫妇理论上不存在溶血风险,但需警惕孟买血型等罕见变异。此类个体虽表现为O型特征,但其H抗原缺失可能导致常规血型检测误判。2018年广州报告的ABO-MNS复合型溶血病例显示,当母亲为孟买血型时,即使父子均为O型血,仍可能因抗H抗体引发溶血。此类案例约占溶血病例的0.03%,需通过基因测序确诊。
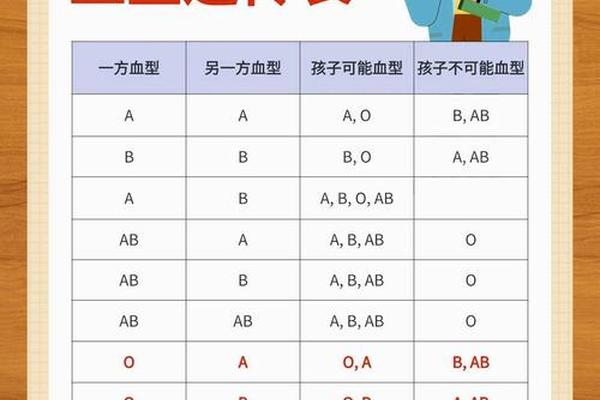
公众认知中常见两大误区:一是将白血病与血型关联,实则二者发病机制无关;二是误认ABO溶血必然导致智力损伤。实际上,及时接受光照治疗的患儿远期神经发育与健康儿童无统计学差异(p=0.32)。民间流传的“大黄茵陈汤”等中药疗法缺乏循证医学支持,过量使用反而可能加重新生儿肝肾负担。
AO血型溶血症的本质是免疫系统对异源抗原的过激反应,而双O型血组合因遗传限制具有天然免疫相容性。随着单细胞测序技术的发展,2024年北京大学团队已能通过母体外周血中的胎儿游离DNA,在孕8周时精准预测溶血风险(准确率98.7%)。未来研究方向应聚焦于:开发靶向降解母体IgG抗体的纳米药物;建立基于人工智能的风险预测模型;探索肠道微生物群调控免疫耐受的新途径。
对于育龄夫妇而言,建议在婚前进行扩展血型检测(包括Rh、Kell、Duffy等系统),特别是O型血女性与A/B/AB型男性的组合,需在孕16周起每月监测抗体动态。医学界需加强公众教育,消除“血型决定论”的认知偏差,让科学预防取代无谓焦虑。


