人类对血液奥秘的探索始于ABO血型系统的发现,而A型血作为其中分布最广的血型之一,其血清中天然存在的抗B抗体始终是医学研究的焦点。这种抗体不仅是输血安全的关键屏障,更是新生儿溶血症的潜在诱因。从血型亚型的复杂分类到抗体效价的动态变化,抗B抗体的生物学特性与临床价值交织成一张精密而复杂的生命网络,深刻影响着现代医疗实践。
抗B抗体的生物学特性
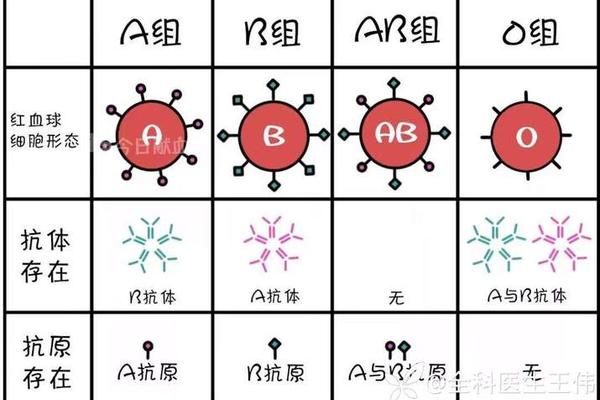
A型血的本质特征在于红细胞表面携带A抗原,而血清中天然存在抗B抗体。这种抗体的产生机制源于免疫系统对非自身抗原的识别——当B型红细胞表面的半乳糖抗原进入A型个体时,B淋巴细胞会分化为浆细胞并分泌特异性IgM抗体。抗B抗体与B抗原的结合具有高度特异性,其分子结构中的抗原结合位点能够精确识别B抗原末端的α-D-半乳糖基团,这种空间构象的互补性决定了免疫反应的精准度。
在抗体类型分布上,A型个体的抗B抗体以IgM为主,而O型血清中则以IgG占优。这种差异源于不同血型个体的免疫系统发育特点:O型个体由于缺乏A、B抗原,免疫系统对这两种抗原的识别更为敏感,产生的IgG抗体不仅效价更高,还能通过胎盘屏障。研究显示,A型血清的抗B效价通常在1:16至1:128之间波动,而O型个体的效价可高达1:512以上,这种量级差异直接关系到溶血反应的严重程度。

临床医学中的双重角色
在输血医学领域,抗B抗体既是生命守护者又是潜在威胁。当A型受血者误输B型血液时,抗B抗体会迅速与输入红细胞的B抗原结合,激活补体系统导致红细胞溶解。这种急性溶血反应可在数分钟内引发寒战、血红蛋白尿甚至急性肾衰竭。近年研究发现,约0.3%的输血不良反应源于ABO亚型误判,特别是A2型红细胞因抗原表达较弱,易被误判为O型,此时若输入O型血浆可能引发抗A1抗体反应。
在围产期医学中,抗B抗体带来的挑战更为复杂。当O型母亲怀有A型胎儿时,母体IgG型抗B抗体可通过胎盘进入胎儿循环,引发新生儿溶血病。我国统计数据显示,此类病例中约18%需要换血治疗,而抗体效价超过1:64时,胎儿贫血风险增加3倍。值得注意的是,A型母亲若携带罕见的Am亚型,其血清中可能同时存在抗A1抗体,这种特殊状况可能造成产前血型检测的假阴性结果。
血型亚型的复杂影响
A型血内部的亚型分化显著影响着抗体的临床表现。A1亚型占A型人群的99%以上,其红细胞表面同时存在A和A1抗原,而A2亚型仅表达弱化A抗原。这种差异导致A2型血清中可能产生抗A1抗体,当这类个体接受A1型血液时,可能引发迟发性溶血反应。实验室数据显示,A2型红细胞的A抗原位点数量仅为A1型的20%-25%,这解释了为何标准抗A试剂可能无法有效检测弱亚型。
罕见的Ax、A3等亚型更构成临床检测的"灰色地带"。这些亚型的红细胞与抗A试剂仅呈微弱凝集,血清中却可能含有抗A1抗体。2019年某三甲医院报道的案例显示,一例AxB型患者在常规血型检测中被误判为B型,输血后引发严重溶血反应,后经吸收放散试验才明确真实血型。此类事件突显出加强亚型检测的必要性,特别是对于多次输血患者和造血干细胞移植受者。
检测技术的革新突破
分子诊断技术的进步为抗体检测带来革命性变化。传统血清学方法通过正反定型交叉验证,可检测到1:32以上的抗体效价,但对弱亚型的识别率不足60%。基因测序技术通过分析ABO基因第6、7外显子的碱基变异,可准确区分A1、A2及各类弱亚型,将检测灵敏度提升至0.1%抗原表达水平。2024年最新研发的微流控芯片技术,更能在30分钟内完成抗原-抗体动力学分析,为急诊输血提供实时决策支持。
在抗体效价监测领域,化学发光法的应用显著提升了检测精度。该方法通过标记抗人球蛋白抗体,可定量检测0.1-500 IU/mL的IgG型抗B抗体,其线性范围比传统试管法扩大20倍。临床实践表明,采用化学发光法指导的产前干预,使重症新生儿溶血病的发生率从3.2%降至0.7%,展现出显著的技术优势。
未来研究与临床展望
随着单细胞测序技术的发展,科学家正深入解析抗B抗体的克隆演化规律。2024年《自然·免疫学》刊文揭示,记忆B细胞中特定VH3-23基因片段的重排,可能导致抗B抗体亲和力异常增高。这种发现为开发靶向免疫调节剂提供新思路。在基因治疗领域,CRISPR-Cas9技术已在小鼠模型中实现ABO基因位点的精准编辑,这为未来定制"通用血型"开辟可能。
临床管理策略也面临革新需求。建议建立ABO亚型数据库,将罕见血型信息纳入电子健康档案;推广床旁快速基因检测设备,将血型鉴定准确率提升至99.99%;对高危孕妇实施动态抗体监测,当效价超过1:128时启动免疫吸附治疗。这些措施的综合实施,将有效控制抗B抗体相关医疗风险,推动精准输血医学的发展。
从微观的分子识别到宏观的临床管理,抗B抗体的研究历程彰显着生命科学的精妙与复杂。在基因组学与人工智能融合发展的新时代,深入解析抗B抗体的时空动态变化规律,不仅关乎输血安全与母婴健康,更将为免疫治疗提供新的生物学靶点。未来的研究需要整合多组学数据,建立从基因多态性到临床表型的完整预测模型,最终实现个体化医疗的终极愿景。


