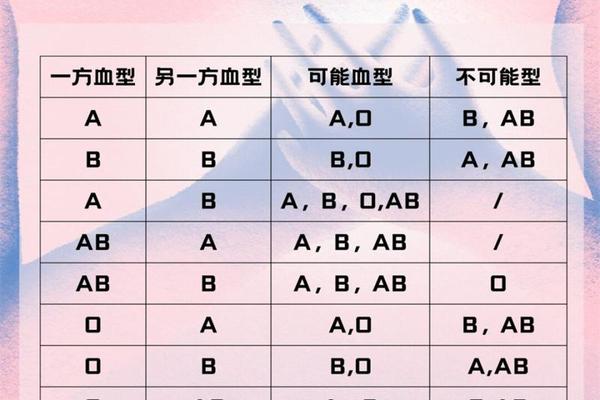
ABO血型系统中,A型血作为最常见的血型之一,其亚型的发现可追溯至20世纪初。1911年,Von Dungern和Hirszfield首次观察到部分A型个体的红细胞抗原表达强度存在差异,由此揭开了A亚型研究的序幕。1930年,Landsteiner和Levine正式将主要亚型命名为A1和A2,其中A1型占A型人群的99%以上,而A2型仅占不足1%。
A1亚型的独特之处在于其红细胞表面同时携带A抗原和A1抗原,而A2型仅表达A抗原。这种差异源于糖基转移酶的基因突变:A1型基因编码的酶能够催化N-乙酰氨基半乳糖与3型H链末端的半乳糖结合,形成重复结构的A抗原;而A2型基因因移码突变导致酶活性改变,无法完成这一过程。这种分子层面的差异不仅决定了抗原的质与量,更直接影响临床血型鉴定的准确性。
二、A1亚型的血清学特征与检测挑战
在血清学检测中,A1亚型的鉴定依赖于特异性抗体反应。B型个体的血清含有抗-A和抗-A1两种成分,其中抗-A1能与A1红细胞发生凝集,而对A2型无反应。这一特性被用于开发抗-A1试剂:通过吸附B型血清中的抗-A成分,保留抗-A1用于亚型鉴别。
A1亚型的检测仍面临三大挑战:其一,抗原表达强度存在个体差异,部分弱表达个体易被误判为O型;其二,A2型血清中可能含有抗-A1抗体,导致交叉配血困难;其三,常规抗-A试剂对A1和A2的敏感性不同,需结合O型血清(含抗-A、抗-B及抗-AB)进行辅助验证。例如,我国汉族人群中A2型占比不足1%,但若漏检可能引发溶血反应,因此标准化检测流程的建立尤为重要。
三、A1亚型的临床意义与输血安全

A1亚型的临床价值主要体现在输血医学和母婴健康领域。当A2型受血者输入A1型血液时,血清中的抗-A1抗体可能引发迟发性溶血反应。尽管多数抗-A1抗体在37℃下活性较弱,但仍有文献报道其导致血红蛋白尿和肾功能损伤的案例。在母婴血型不合的妊娠中,O型母亲若怀有A1型胎儿,其IgG型抗-A抗体可通过胎盘引发新生儿溶血病,这种风险显著高于A2型胎儿。
统计数据显示,A1B型红细胞抗原数量仅为A1型的1/4,这解释了为何A2B型个体更易被误判为B型。对此,WHO建议对献血者进行亚型筛查,尤其在高加索人群等A2型高发地区,需采用分子生物学技术(如PCR-SSP)辅助血清学检测,将误判率控制在0.01%以下。
四、遗传机制与分子生物学研究进展
A1与A2亚型的遗传差异源于ABO基因第7外显子的单核苷酸变异。A1型基因在cDNA第1061位保持完整阅读框,而A2型因第1059-1061位的胞嘧啶缺失(CCC→CC),导致移码突变并延长肽链21个氨基酸。这种结构改变使A2型转移酶的底物特异性发生偏移,无法催化3型H链的糖基化。
近年研究还发现,ABO基因的调控区突变(如启动子区CpG岛甲基化)可能导致抗原表达量的波动,这解释了部分Ax型个体的弱抗原现象。基因编辑技术(如CRISPR-Cas9)已成功构建A1/A2细胞模型,为研究抗原-抗体相互作用提供了新工具。
五、未来研究方向与精准医疗应用
随着单细胞测序技术的发展,A亚型研究正从群体水平转向个体化分析。例如,通过建立红细胞抗原表达谱数据库,可预测不同亚型个体对特定疾病的易感性。已有研究表明,A1型人群的胃癌发病率较A2型高17%,可能与H.pylori对3型A抗原的亲和性有关。
在输血医学领域,开发基于纳米抗体的快速检测芯片成为趋势。这类芯片可同时识别A1、A2、A3等亚型抗原,检测灵敏度达0.1ng/mL,较传统凝胶卡法提升100倍。合成生物学技术正在尝试人工合成通用型红细胞,通过酶解法去除A/B抗原,有望彻底解决亚型输血难题。
A1亚型的研究历程揭示了血型系统的复杂性与临床重要性。从最初的血清学观察到如今的分子机制解析,这一领域的发展始终与医学实践紧密交织。未来,整合多组学数据的个体化血型分析将重塑输血安全体系,而基因编辑技术的应用可能开创抗原改造的新纪元。对于临床工作者而言,深入理解A亚型的生物学特性,既是保障输血安全的基础,也是推动精准医疗发展的关键一环。


