血液的输注是挽救生命的重要手段,但血型系统的复杂性决定了其必须遵循严格的免疫学规则。AB型血因其红细胞表面同时携带A、B抗原的特性,在输血医学中被称为“万能受血者”,但这种描述背后隐藏着复杂的生物学机制和临床实践中的谨慎考量。本文将从免疫学原理、输血策略、临床操作规范等角度,系统解析AB型血的输血逻辑。
一、AB型血的抗原抗体特性
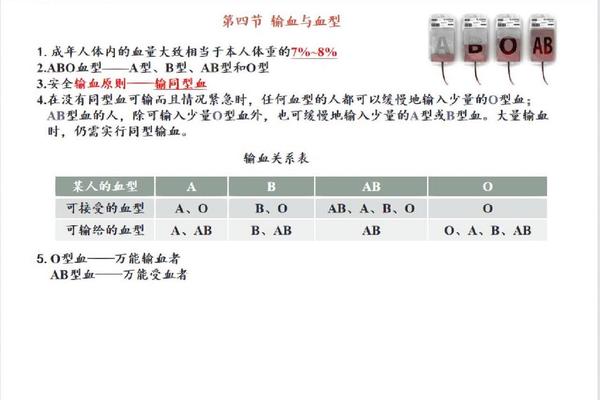
AB型血的核心特征在于其红细胞膜上同时存在A、B两种抗原,而血清中既不含有抗A抗体,也不含有抗B抗体。这种独特的免疫学特征来源于ABO基因的显性表达:当个体从父母处分别遗传到A和B等位基因时,红细胞会同时合成两种抗原。由于缺乏针对自身抗原的抗体,理论上AB型血患者的血清不会攻击任何外来红细胞,这构成了其作为“万能受血者”的基础。
这种特性仅限于红细胞成分的输入。当涉及血浆输注时,AB型血的包容性将发生逆转——例如A型血浆中含有的抗B抗体会与AB型患者的B抗原结合,导致溶血反应。现代输血医学强调成分分离原则:AB型患者可接受任何血型的红细胞悬液,但血浆必须严格匹配AB型。
二、同型输血的临床优先原则
尽管AB型血具有广泛的受血兼容性,但临床指南仍将同型输血列为首选方案。这主要基于两方面考量:异型输血可能引发次侧凝集反应。例如O型血血浆中的抗A、抗B抗体若未被充分稀释,可能攻击受血者的红细胞;ABO系统外的血型抗原(如Rh因子)仍需严格匹配,AB型Rh阴性患者只能接受Rh阴性血液。
在手术室的实际操作中,输血科会通过交叉配血试验验证相容性。主侧试验检测供者红细胞与受者血清的凝集情况,次侧试验则观察供者血清与受者红细胞的反应。只有当主侧无凝集时,异型输血才被允许,且需控制输注速度和总量(通常不超过400ml)。例如某案例显示,AB型患者输入A型红细胞悬液前,需确保其血浆抗体效价低于1:200。
三、特殊场景的输血策略调整
在创伤急救等紧急情况下,AB型血的兼容性优势尤为突出。当血库AB型血储备不足时,可按照“红细胞兼容性阶梯”选择替代方案:首选AB型红细胞,次选A型或B型,最后考虑O型。但需注意,这种应急措施仅限于红细胞成分,且需同步输注AB型血浆以避免抗体暴露。
对于新生儿溶血病等特殊病例,输血策略需进一步细化。由于胎儿免疫系统尚未成熟,AB型母亲若孕育O型胎儿,可能因胎盘出血导致抗体传递。此时需采用经γ射线照射的O型洗涤红细胞,并严格监测胆红素水平。某三甲医院数据显示,此类病例的输血不良反应率可从常规的0.5%降至0.1%以下。
四、输血安全的全程管理
现代输血医学建立了一套严密的质量控制体系。在AB型血输注过程中,护士需执行“三查十对”流程:核查血袋标签完整性、血液有效期、交叉配血结果等10项关键信息。温度控制同样至关重要,解冻后的血浆需在30分钟内开始输注,血小板则应维持在22℃震荡保存。
并发症防治方面,溶血反应是最严重的风险。研究表明,AB型患者接受异型输血时,迟发性溶血反应发生率约为0.03%,主要表现为输血后2-21天出现血红蛋白尿。临床建议在输血后48小时内监测乳酸脱氢酶和结合珠蛋白水平,这对早期识别溶血迹象具有重要价值。
五、未来研究方向与挑战
随着基因编辑技术的发展,科学家正在探索通过CRISPR技术改造红细胞抗原。2024年《自然》期刊报道的实验显示,敲除ABO基因的红细胞可在动物模型中实现跨血型输注,这或将彻底改变AB型血的供应困境。液态活检技术的进步使得通过游离DNA检测患者血型成为可能,这对急诊输血具有革命性意义。
在临床实践层面,建立区域性AB型血动态储备网络成为研究热点。基于人工智能的预测模型可整合手术排期、季节性疾病谱等数据,将AB型血的库存误差率从15%降至5%以内。而新型血液替代品(如血红蛋白氧载体)的Ⅲ期临床试验数据显示,其在外科手术中的替代效率达到天然红细胞的82%。
AB型血的输血实践深刻体现了精准医学的内涵:既要利用其免疫学特性提高救治效率,又需通过严格质控规避潜在风险。随着分子生物学和人工智能技术的融合,未来的输血医学将朝着个性化、智能化的方向发展。但无论技术如何进步,“安全优先”始终是临床操作不可逾越的底线,这需要医务人员持续更新知识体系,在传统经验与创新技术间寻求最佳平衡点。


