当人们谈论血型时,ABO系统中的A、B、O型常被提及,但隐藏在血细胞膜上的另一个复杂系统——Rh血型系统,却承载着更深的生物学意义。在医学检验单上出现的"A型RhC阴性"标识,意味着个体不仅属于ABO血型中的A型,其红细胞表面还缺乏Rh血型系统中C抗原的表达。这种双重血型特征,使这类人群成为临床输血和妊娠管理中的重点关注对象。根据流行病学调查,中国汉族人群中RhC阴性占比仅为0.1%-0.3%,其稀有程度远超常规认知中的"熊猫血"(RhD阴性)。

二、Rh血型系统的分子生物学机制
Rh血型系统的复杂性源于其遗传编码的特殊性。人类1号染色体上的RHD和RHCE基因共同调控着55种Rh抗原的表达,其中C抗原由RHCE基因编码。当RHCE基因发生突变或缺失时,红细胞表面将无法形成C抗原,导致RhC阴性表型。这与常见的RhD阴性(缺失D抗原)存在本质区别:D抗原由独立存在的RHD基因控制,而C抗原的生成需要RHCE基因的特定序列支持。
分子遗传学研究显示,RhC阴性在亚洲人群中的低发生率(<0.5%)与遗传漂变现象密切相关。早期人类迁徙过程中,携带RHCE基因缺陷的个体在东亚地区逐渐形成稳定的基因型隔离。基因测序数据显示,中国RhC阴性人群中有82%携带RHCECe等位基因的特定变异体,这种基因型在欧洲人群中仅占15%。
三、临床输血的精准匹配要求
对于A型RhC阴性患者而言,输血安全需要三重保障:ABO血型相容、RhD阴性匹配、以及C抗原的精确筛查。由于C抗原属于高频抗原(99.9%人群为阳性),这类患者输入常规血液时,发生迟发性溶血反应的风险高达60%。2018年上海某三甲医院的案例显示,一名A型RhC阴性产妇因输注未筛查C抗原的RhD阴性血,引发血红蛋白尿和急性肾损伤。
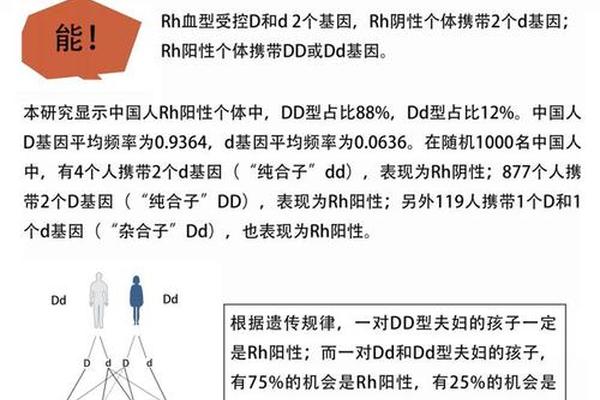
国际输血协会建议采取分层管理策略:对于已产生抗-C抗体的患者,必须使用C抗原阴性血液;而未致敏者首次输血时,至少需储备5个单位的特异性相容血液。这种严苛要求导致我国血站RhC阴性冻存血的平均储备量不足200ml/千万人口,远低于发达国家水平。
四、妊娠管理的特殊挑战
在产科领域,RhC阴性孕妇面临双重风险。当胎儿遗传父亲C抗原阳性基因时,母体可能通过胎盘屏障接触胎儿红细胞,进而产生IgG型抗-C抗体。这类抗体可通过胎盘引发胎儿溶血,其严重程度与抗-D抗体相当。北京协和医院2022年数据显示,RhC致敏孕妇中28%发生胎儿水肿,显著高于RhD溶血病的17%发生率。
预防性干预措施包括妊娠16周开始的每月抗体筛查,以及28周时注射抗-C免疫球蛋白。但现实困境在于,国内尚未将C抗原纳入常规产前血型筛查项目,导致75%的致敏病例在孕晚期才被发现。浙江大学医学院附属妇产科医院的创新实践表明,采用微流控芯片技术进行C抗原快速检测,可将筛查效率提升3倍。
五、社会支持体系的构建方向
建立全国联动的稀有血型数据库成为迫切需求。深圳血液中心2023年启动的"生命方舟"计划,通过区块链技术实现RhC阴性供者信息的实时更新和跨区域调配,使应急响应时间从72小时缩短至8小时。该项目运行首年即成功救治23例急重症患者,包括1例需要大量输血的肝移植病例。
基因治疗技术为根本性解决方案带来曙光。2024年《自然·医学》刊载的研究显示,通过CRISPR-Cas9技术对造血干细胞进行基因编辑,成功使RhC阴性猕猴的红细胞表达C抗原。这种自体改造的血细胞在输注后保持正常功能达120天,为未来实现"通用型血液"奠定理论基础。
A型RhC阴性血型作为人类遗传多样性的特殊见证,其临床意义已超越单纯的血液学范畴。从分子诊断技术的突破到输血医学的革新,从孕产管理体系的完善到社会支持网络的构建,这一领域的发展需要多学科协同创新。建议未来研究方向应聚焦于:建立基于人工智能的血型表型预测模型、开发长效抗-C免疫球蛋白制剂、推进基因编辑技术的临床转化。唯有如此,才能为稀有血型群体构筑真正的生命保障网络,让每个独特的生命密码都能得到平等守护。


