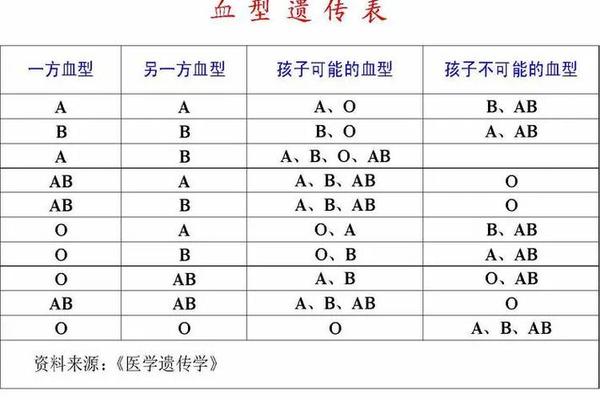
血液是人体最复杂的生命物质之一,而ABO血型系统作为临床医学的重要基石,始终是医学研究的焦点。在常规认知中,ABO血型仅包含A、B、AB、O四种类型,但近年来的分子生物学研究揭示了一个更复杂的血型世界——其中B(A)血型因其基因突变特征与临床误判风险,成为输血医学领域的特殊研究对象。这种血型的红细胞表面同时存在B抗原和微量A抗原,其人群发生率仅为五十万分之一至百万分之一,其背后不仅涉及遗传学规律的重构,更关乎输血安全与遗传。
基因突变的分子机制
B(A)血型的本质源自ABO基因的罕见突变。正常情况下,B型血由B基因编码的α-1,3-半乳糖转移酶催化形成B抗原。然而在B(A)血型中,B基因的核苷酸序列发生点突变(如234或235位氨基酸改变),使得该酶在转移半乳糖形成B抗原的意外激活了转移N-乙酰半乳糖胺的能力,从而在红细胞表面生成微量A抗原。这种“一酶双功能”现象打破了传统ABO血型系统的二元划分规则。
分子遗传学研究表明,这种突变属于顺式遗传模式。在染色体配对过程中,突变的B基因与正常O基因组合形成B(A)/O基因型,使得携带者既表现出显性B抗原,又因突变酶活性产生弱A抗原。这种基因型在常规血清学检测中常被误判为AB型或B型,只有通过基因测序技术才能准确识别其本质。
血清学检测的复杂性
在常规血型鉴定中,B(A)血型呈现出独特的血清学特征。正定型检测时,抗A试剂与红细胞的弱反应常导致结果波动:初判可能显示B型,随着反应时间延长出现AB型假象,但轻摇后凝集颗粒又易散开。这种动态变化源于微量A抗原的弱表达特性,其凝集强度通常低于2+,与典型AB型存在显著差异。
反定型检测则呈现更明显的矛盾性。由于血清中含有正常B型个体的抗A抗体,当与标准A细胞反应时会出现凝集,这与正定型的弱A抗原表现形成逻辑冲突。这种正反定型不符的现象,被输血科称为“血清学陷阱”。2017年江西省血液中心发现的2例B(A)血型案例显示,使用微柱凝胶法检测时,其血清学特征与A2B亚型极其相似,必须依赖PCR-SSP或基因测序技术才能明确诊断。
临床输血的潜在风险
B(A)血型的误判可能引发严重临床后果。若将其误判为AB型,接受AB型血浆输注时,供体血浆中的抗B抗体会攻击受血者的B抗原,导致溶血反应;若误判为B型,其红细胞表面的微量A抗原又可能引发A型受血者的免疫应答。美国血库协会(AABB)指南特别指出,对此类罕见血型应选择O型洗涤红细胞或同型洗涤红细胞进行输注,并将患者信息录入罕见血型数据库。
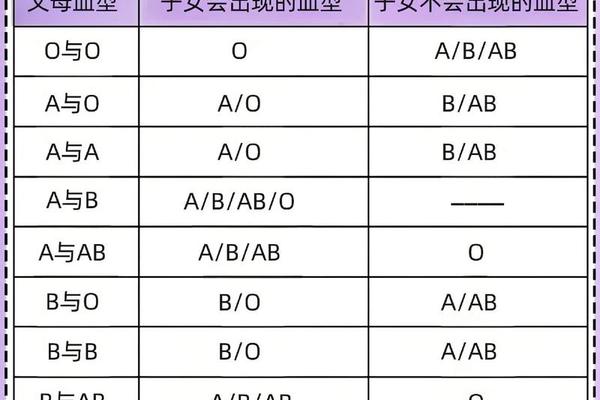
更值得关注的是其遗传学引发的问题。由于B(A)血型的遗传不符合孟德尔定律,亲子代血型可能出现“违反”常规遗传规律的现象。例如B(A)型父亲与O型母亲可能生育出AB型子女,这种情况极易引发家庭信任危机。2021年长冶医学院的案例显示,通过短串联重复序列(STR)分析和单核苷酸多态性(SNP)检测,可有效区分真正的血缘关系与血型异常。
研究进展与未来方向
当前对B(A)血型的研究已从表型描述深入到基因调控层面。上海交通大学团队通过对B(A)04等位基因的功能研究,发现其酶活性区域的关键氨基酸替换(如Gly234Ser)是导致双功能活性的结构基础。北京血液中心建立的罕见血型分子诊断平台,可将检测灵敏度提升至0.1%突变等位基因频率,为临床精准分型提供技术保障。
未来研究需要突破三个维度:其一,建立全国性罕见血型动态监测网络,目前江西省已率先开展B(A)血型档案库建设;其二,开发快速检测试剂盒,日本学者提出的抗-A1 lectin特异性检测法已在小样本试验中实现90%检出率;其三,探索基因编辑技术在红细胞体外培养中的应用,通过CRISPR-Cas9技术修饰ABO基因,或可为罕见血型患者定制安全血源。
B(A)血型的存在,不仅揭示了ABO血型系统的复杂性,更凸显了精准医学在输血安全中的核心价值。从血清学误判到基因诊断的技术跨越,从危机到分子遗传学的真相还原,这一罕见血型的研究历程深刻诠释了基础科研与临床实践的互动关系。随着单细胞测序技术和人工智能算法的进步,未来或将构建出涵盖所有ABO亚型的全球血型图谱,让每一个特殊血型个体都能获得精准的医疗照护。这既是输血医学发展的必然方向,也是对生命多样性最本质的尊重。


