在医学领域,父母血型与新生儿健康的关系始终备受关注。当父母分别为A型和B型血时,孩子可能继承A、B、AB或O型血型,这种遗传多样性使得部分家庭担忧孩子是否可能因母婴血型不合引发溶血性疾病。本文将从科学角度解析此类血型组合下新生儿溶血症的发生机制、风险因素及应对策略,为家庭提供科学指导。
一、血型遗传与溶血风险

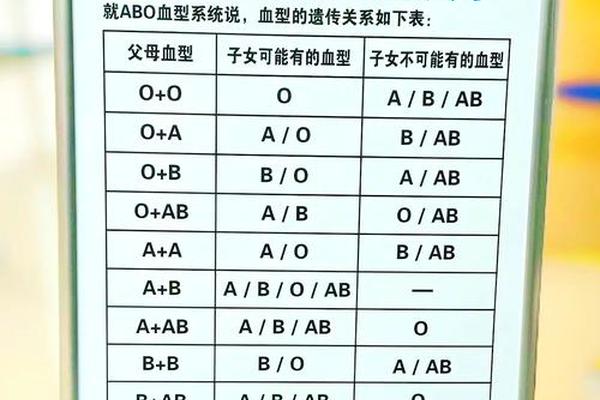
父母为A型和B型血时,孩子的血型遗传遵循孟德尔定律。A型血的基因型可能为AA或AO,B型血则为BB或BO,因此孩子可能呈现A(25%)、B(25%)、AB(25%)或O型(25%)。需要明确的是,ABO血型系统本身并不会直接导致溶血症,其风险主要与母体免疫系统对胎儿红细胞抗原的识别反应相关。
母婴血型不合引发的溶血反应需满足两个核心条件:一是胎儿红细胞携带母体缺乏的抗原,二是母体已产生针对该抗原的IgG类抗体。例如,若母亲为A型血(含抗B抗体),胎儿为B型或AB型,则母体可能通过胎盘将抗B抗体传递至胎儿体内,导致红细胞破坏。但值得注意的是,A型血母亲天然存在的抗B抗体多为IgM型,分子量大无法通过胎盘屏障,只有当既往接触B型抗原(如输血、流产史)产生IgG抗体时,才可能引发溶血。
二、溶血症的发生机制
溶血症的本质是抗原-抗体介导的免疫反应。当母体血液中的IgG抗体通过胎盘进入胎儿循环系统后,会与胎儿红细胞表面的A或B抗原结合,激活补体系统,导致红细胞膜破裂,释放大量游离胆红素。胆红素代谢异常不仅引起皮肤黄染(黄疸),更可能穿透血脑屏障造成神经损伤(核黄疸)。
相较于Rh血型系统的高危性(如Rh阴性母亲怀Rh阳性胎儿),ABO血型不合引发的溶血症状通常较轻。研究显示,仅有1/5的ABO血型不合妊娠会出现抗体效价升高,其中仅约1/3新生儿出现临床症状。这是因为胎儿红细胞表面的A/B抗原发育不完全,且其他组织细胞(如胎盘细胞)也表达此类抗原,可部分中和抗体活性。
三、临床表现与诊断方法
ABO溶血症的典型症状包括出生后24小时内迅速加重的黄疸(血清胆红素>12mg/dL)、贫血(血红蛋白<14g/dL)及肝脾肿大。约15%的重症患儿可能出现嗜睡、吸吮力减弱等神经系统前兆,提示胆红素脑病风险。值得注意的是,由于胎儿可通过外造血代偿,产前超声可能观察到胎盘增厚(>4cm)或胎儿腹腔积液等间接征象。
实验室诊断需结合母体抗体效价测定与新生儿溶血三项试验。孕中期(16-18周)通过母体血清抗A/B效价检测,若效价≥1:64提示高风险。新生儿出生后,直接抗人球蛋白试验(Coombs试验)阳性、游离抗体检测及红细胞抗体释放试验可确诊。近年来无创产前DNA检测技术可早期评估胎儿血型,降低侵入性检查风险。
四、预防与治疗策略
对于已致敏的孕妇,孕28周起需每2周监测抗体效价,并通过超声多普勒评估胎儿大脑中动脉血流峰值速度(MCA-PSV),该指标>1.5倍中位数时提示严重贫血,需考虑宫内输血。光照疗法仍是新生儿黄疸的首选治疗,蓝光(425-475nm)可使胆红素异构体加速排泄,当血清胆红素>20mg/dL时需换血治疗。
预防层面,建议所有A/B型血女性孕前进行配偶血型筛查及抗体检测。有反复流产史者,需排查是否存在隐匿性致敏。Rh阴性母亲虽不属于ABO溶血高风险群体,但若同时存在Rh与ABO血型不合,需在孕28周及产后72小时内注射抗D免疫球蛋白,阻断抗体生成。避免非必要输血、规范流产术后管理可降低初次致敏概率。
总结而言,父母A型与B型血组合的新生儿溶血症总体发生率较低,且多数症状可控。通过科学的孕前筛查、孕期动态监测及产后及时干预,可有效降低疾病危害。未来研究可进一步探索基因编辑技术对胎儿抗原表达的调控,或开发特异性免疫吸附剂清除母体循环抗体,为高风险家庭提供更优解决方案。


