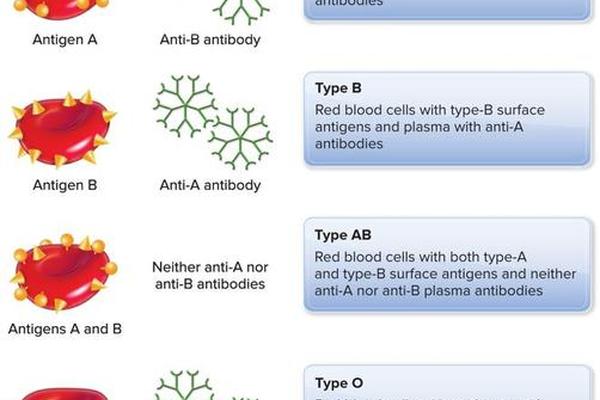
AB血型作为人类ABO血型系统中的特殊存在,其红细胞表面同时携带A、B两种抗原,而血清中既不含有抗A抗体也不含抗B抗体。这种独特的抗原-抗体格局使其在输血医学、遗传学研究及疾病关联性分析中占据重要地位。从免疫学角度看,AB型个体的免疫耐受机制与抗原表达调控为医学界提供了研究免疫应答的天然模型;从临床实践角度,AB型“万能受血者”的称号背后隐藏着复杂的生物学逻辑与潜在风险。本文将深入探讨AB血型抗原抗体的分子基础、遗传特性及其在临床医学中的多维影响。
抗原结构与生化特性
AB血型的抗原形成依赖于ABO基因编码的糖基转移酶活性。A抗原的核心结构是H抗原(由FUT1基因编码的岩藻糖转移酶催化形成)经α-1,3-N-乙酰半乳糖胺转移酶修饰后的产物,而B抗原则是H抗原经α-1,3-半乳糖转移酶作用的结果。这两种酶分别由A和B等位基因调控,使得AB型红细胞膜上同时呈现A、B抗原的糖链结构。
抗原的空间分布特征直接影响免疫识别效率。通过冷冻电镜技术发现,A、B抗原以树枝状结构突出于红细胞膜表面,每个抗原位点间距约10-15nm,这种排列密度既能保证抗原抗体的有效结合,又避免了过度聚集导致的凝集反应。值得注意的是,AB型抗原存在亚型分化,如A2B亚型中A抗原的糖基化程度降低,可能导致交叉配血时的微弱凝集现象。
血清抗体缺失机制
AB型血清中抗A、抗B抗体的缺失与其免疫耐受机制密切相关。正常情况下,人体在出生后6-18个月通过肠道菌群接触A/B类似抗原,诱导产生相应抗体。但AB型个体的免疫系统因持续暴露于自身A、B抗原,导致B细胞克隆被选择性删除或失能,形成中枢性耐受。这一过程涉及中未成熟B细胞表面BCR与自身抗原的结合,触发细胞凋亡信号通路。
分子层面的研究揭示了抗体缺失的基因调控网络。单细胞测序数据显示,AB型个体外周血中针对A/B抗原的B细胞受体(BCR)多样性显著降低,其IGHV基因片段使用频率呈现特异性偏移。调节性T细胞(Treg)通过分泌IL-10等细胞因子抑制残余抗体的产生,形成双重保障机制。
临床输血医学影响
在输血实践中,AB型被称为“万能受血者”的理论基础在于其血清中不含抗A/B抗体。但近年研究显示,约2.3%的AB型个体血清中存在低效价IgG类不规则抗体,可能引发迟发性溶血反应。这提示临床需完善抗体筛查流程,尤其对多次输血或妊娠史患者应进行更敏感的凝胶卡检测。
造血干细胞移植领域的新发现颠覆了传统认知。2025年《血液学年鉴》的研究表明,AB型受者接受非AB型供体干细胞后,血型转换时间较其他类型延长30%,血小板输注需求增加42%,其机制可能与残留宿主浆细胞持续分泌同种抗体有关。这要求移植中心优化预处理方案,加强移植物中淋巴细胞亚群的质控。
疾病易感性关联
AB血型与特定疾病的关联性呈现显著统计学差异。全基因组关联研究(GWAS)发现,AB型人群胃癌发病率较O型高1.3倍,可能与幽门螺杆菌表面Lewis抗原与A抗原的分子模拟效应相关。在心血管疾病领域,AB型个体的von Willebrand因子水平较其他血型高25%,导致血栓形成风险增加。
免疫性疾病方面,AB型系统性红斑狼疮(SLE)患者的抗dsDNA抗体阳性率显著低于其他血型,这可能与AB型免疫系统对核酸抗原的识别阈值改变有关。但2024年新生儿溶血症研究显示,AB型母亲孕育A型胎儿时,仍有0.7%概率发生非典型溶血,其机制涉及胎盘屏障异常导致的母体IgG抗体渗漏。
未来研究方向
基因编辑技术的突破为AB血型研究开辟新路径。CRISPR-Cas9介导的ABO基因座定向修饰已在小鼠模型实现血型转换,这为稀有血型库建设提供了技术储备。单细胞多组学技术的应用将深入解析AB型免疫细胞的表观遗传特征,如DNA甲基化模式如何调控抗体相关基因沉默。
临床转化研究需建立更精细的风险评估体系。基于机器学习算法开发的AB型输血风险评估模型,通过整合HLA分型、细胞因子谱等12项参数,可使输血不良反应预测准确率提升至92%。在器官移植领域,开发AB抗原特异性免疫吸附柱,有望突破ABO血型不相容移植的技术瓶颈。
AB血型的生物学特性既是自然选择的杰作,也是医学研究的宝库。随着分子生物学技术的进步,其抗原抗体系统的奥秘正被逐步揭开。未来的研究需在基础机制与临床转化之间架设桥梁,既要阐明AB型免疫耐受的精确调控网络,也要开发个体化医疗方案,最终实现从血型认知到精准医学的跨越。这要求跨学科团队在基因编辑、人工智能辅助诊断、新型生物材料等领域开展深度合作,让AB血型研究真正造福人类健康。


