A型血作为人类ABO血型系统中的重要分支,其溶血风险与免疫反应机制密切相关。在ABO血型不合的情况下,当A型血与其他血型(如O型或B型)结合时,可能因抗原-抗体反应引发溶血。例如,若母亲为O型血而胎儿为A型血,母体血液中天然存在的抗A抗体会通过胎盘攻击胎儿的红细胞,导致新生儿ABO溶血症。
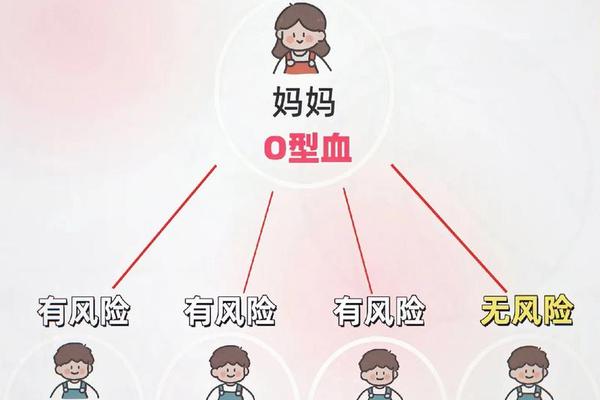
从免疫学角度分析,A型血的红细胞表面携带A抗原,而O型血个体的血清中天然含有抗A和抗B抗体。这种抗体在母婴血型不合时,可穿透胎盘屏障,破坏胎儿红细胞,释放大量胆红素,从而引发黄疸甚至神经损伤。研究显示,A型血新生儿溶血病的发病率约为11.9%,其中母亲为O型、父亲为A型的高危组合占比最高。
值得注意的是,A型血个体的溶血风险并非仅限于母婴场景。在输血过程中,若A型血受者误输B型或AB型血液,同样会因抗原不匹配引发急性溶血反应,表现为寒战、高热甚至肾衰竭。A型血的溶血机制具有多维性和复杂性,需结合具体场景分析。
二、高危血型组合的遗传学分析
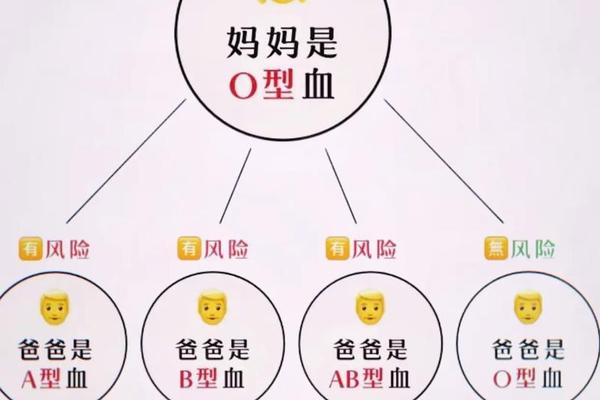
血型遗传规律是预测溶血风险的核心依据。A型血与不同血型组合的遗传结果差异显著,尤其当父母存在ABO或Rh血型不合时,后代溶血概率显著升高。例如,若父母一方为A型(基因型AA或AO)、另一方为B型(基因型BB或BO),胎儿可能携带AB型或O型血,此时母体免疫系统可能将胎儿红细胞识别为“异物”并发起攻击。
对于Rh血型系统,若母亲为Rh阴性(如A型Rh-),父亲为Rh阳性(如A型Rh+),胎儿遗传Rh阳性血型的概率为50%。这种情况下,母体可能在妊娠或分娩过程中接触胎儿红细胞并产生抗D抗体,导致后续妊娠中胎儿发生Rh溶血症。数据显示,Rh阴性血型人群仅占全球人口的15%,但此类溶血病的严重性远高于ABO溶血,可能引发胎儿水肿或死胎。
值得注意的是,隐性基因也可能影响溶血风险。例如,父母均为A型血(基因型AO),胎儿有25%概率为O型血。若母亲体内存在高效价抗A抗体,仍可能对胎儿造成轻微溶血,表现为出生后黄疸。血型基因的显隐性关系与抗体效价共同决定了溶血的发生强度。
三、溶血的临床管理与预防策略
针对A型血相关溶血风险,现代医学已形成系统的预防与干预体系。在孕期管理中,O型或Rh阴性血型孕妇需定期检测抗体效价。例如,O型血孕妇在妊娠16周、28周需进行抗A/B抗体筛查,若效价超过1:128,提示需通过药物(如茵栀黄颗粒)或免疫球蛋白治疗降低胎儿风险。
对于已确诊的新生儿溶血症,分层治疗策略至关重要。轻度病例可通过蓝光照射分解胆红素,降低核黄疸风险;中重度病例需结合丙种球蛋白输注或换血疗法。研究显示,采用小剂量利妥昔单抗(100 mg/d)可有效抑制母体抗体生成,且经济性和安全性更优。Rh阴性母亲在产后72小时内注射抗D免疫球蛋白,可使下一胎Rh溶血风险降低90%。
在输血医学领域,A型血受者的交叉配血需格外谨慎。除了ABO系统匹配外,还需筛查Rh、Kell等次要血型抗原。数据显示,约0.3%的输血反应源于罕见的Kidd或Duffy血型不合,这类溶血常表现为迟发性血红蛋白尿。输血前的扩展抗原检测已成为临床标准操作。
四、未来研究方向与挑战
尽管现有手段已显著降低溶血相关死亡率,但部分难题仍待突破。例如,约5%的ABO溶血患儿会出现晚期贫血,其机制可能与持续性慢性溶血有关,需开发靶向红细胞膜修复的疗法。基因编辑技术的进步为根治遗传性溶血病(如球形红细胞增多症)提供了可能,但和安全性问题仍需审慎评估。
血型抗体动态监测技术的精准化是重要趋势。新型微流控芯片可同时检测抗A/B效价和补体活性,将筛查时间从24小时缩短至2小时,尤其适用于急诊输血场景。在公共卫生层面,建立区域性稀有血型库、推广产前血型基因分型,将成为降低社会医疗负担的关键举措。
总结
A型血的溶血风险贯穿于母婴健康、输血安全及遗传疾病等多个领域。通过解析ABO/Rh血型系统的免疫机制,结合抗体效价监测、分层治疗和基因筛查,可显著降低溶血危害。未来,跨学科技术的融合与精准医疗的深化,有望为血型相关疾病的防治开辟新路径。对于A型血个体及其家庭而言,主动参与产前检测、完善血型档案管理,是规避风险的核心策略。


