A型血是ABO血型系统中最为复杂的类型之一,其进一步划分为A+和A-的差异源于Rh血型系统的存在。Rh血型系统由红细胞表面是否存在D抗原决定,携带D抗原者为Rh阳性(如A+),反之为Rh阴性(A-)。这一分类在临床输血和妊娠管理中具有关键意义。例如,Rh阴性个体若输入Rh阳性血液,可能因免疫反应产生抗D抗体,导致溶血风险;而Rh阴性孕妇若怀有Rh阳性胎儿,可能引发新生儿溶血病。
从分子机制看,Rh抗原的表达由位于1号染色体短臂的RHD和RHCE基因调控。RHD基因编码D抗原,其缺失或突变是导致Rh阴性的主要原因。全球范围内,Rh阴性血型占比不足15%,而中国汉族人群中Rh阴性比例仅约0.3%-0.5%,这使得A-血型成为稀有血型。值得注意的是,Rh系统包含超过50种抗原,但临床实践中主要关注D抗原的检测,因其免疫原性最强。
A型血的遗传规律与Rh因子的传递
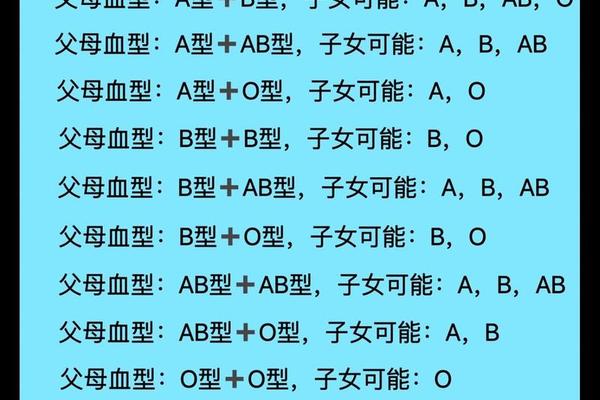
A型血的ABO遗传遵循孟德尔定律,父母双方各提供一个等位基因。当父母基因型为AA或AO时,子女可能表现为A型或O型。而Rh因子的遗传具有显性特征:若父母双方均为Rh阴性(dd),子女必然为Rh阴性;若一方为Rh阳性(DD或Dd),子女可能携带D抗原。例如,A+血型父母(基因型Dd)生育A-子女的概率为25%,这种隐性遗传模式解释了Rh阴性血型的家族聚集现象。
临床案例显示,当A-血型母亲首次妊娠为A+胎儿时,胎儿的D抗原可能通过胎盘进入母体,刺激母体产生抗D抗体。在第二次妊娠中,这些抗体会攻击胎儿的红细胞,导致胎儿贫血甚至死亡。Rh阴性孕妇需在妊娠28周及分娩后72小时内注射抗D免疫球蛋白,阻断母体致敏过程。这一干预措施使新生儿溶血病发病率从14%降至1%以下。
A+/-血型的临床意义与输血实践
在输血医学中,A+和A-的区分直接关系生命安危。根据ABO-Rh复合血型系统,A+患者可接受A+或O+血液,而A-患者仅能接受A-或O-血液。这种限制源于血浆中抗体的双重作用:A型血含抗B抗体,Rh阴性血含抗D抗体。若输入不匹配血液,抗体-抗原反应会引发血红蛋白尿、肾衰竭等严重并发症。
近年研究指出,Rh阴性患者输注Rh阳性血小板时,虽无即时溶血风险,但可能产生抗D抗体,影响未来妊娠或输血安全。欧美国家已推行“Rh阴性专属血小板库”建设,通过基因分型技术筛选供体,这一举措使血小板输注有效性提升23%。而对于A-血型这一稀有资源,全球建立的“冰冻红细胞库”技术可将红细胞保存期延长至10年,解冻后存活率超过90%。
血型认知误区与科学管理建议
公众对血型存在诸多误解,例如认为“O型是万能供血者”或“AB型可接受任意血液”。实际上,现代输血学强调同型输注原则,仅在紧急情况下允许O型红细胞用于其他血型,且需去除血浆中的抗A/B抗体。对于A-血型人群,建议定期参与稀有血型志愿者登记,并避免在非必要情况下接受异型输血。
在个体健康管理方面,血型与疾病易感性的关联引发关注。例如,A型血人群胃癌发病风险较其他血型高20%,可能与H.pylori感染率较高有关;而Rh阴性个体罹患某些自身免疫病的风险增加。这些发现提示,血型信息应纳入个性化健康管理的考量维度,但需避免过度解读非因果性关联。
未来研究方向与技术革新
基因编辑技术为血型转化带来新可能。2023年日本学者通过CRISPR-Cas9技术,成功将A型红细胞转化为O型,其抗原消除效率达99.8%。这种“通用红细胞”技术若实现临床应用,将极大缓解稀有血型供应压力。基于二代测序的血型基因分型技术,可同时检测ABO、Rh等38个血型系统,误判率低于0.01%。
在血型研究范式上,多组学整合分析成为趋势。例如,结合代谢组学发现A型血人群的N-乙酰半乳糖胺代谢通路活性显著增强,这为解释其特定疾病易感性提供了分子依据。而合成生物学领域,科学家正尝试人工合成携带特定血型抗原的干细胞,这些突破可能改写传统血源依赖模式。
总结
A型血的A+/-分类体系,体现了人类对生命复杂性的认知深化。从输血安全到疾病防控,从遗传咨询到技术创新,这一分类持续推动着医学进步。随着基因检测和细胞工程技术的突破,未来或可实现血型的人为调控,从根本上解决血源短缺问题。建议加强公众血型科普教育,完善稀有血型应急机制,同时推动跨学科研究,挖掘血型系统在精准医学中的潜在价值。


