AB血型作为ABO血型系统中的一种特殊类型,其形成机制源于红细胞表面抗原的独特组合。根据ABO系统的遗传规律,个体的血型由父母双方各提供一个等位基因共同决定,其中A和B为显性基因,O为隐性基因。AB血型的核心特征在于红细胞表面同时存在A抗原和B抗原,而血清中既不含有抗A抗体,也不含有抗B抗体。这种双重抗原的存在,使其在输血医学中具有独特的临床意义。
从分子机制来看,AB血型的形成依赖于H物质的转化。H物质是ABO抗原的前体,由FUT1基因编码的岩藻糖转移酶催化合成。当个体的ABO基因座上存在IA和IB基因时,其产物分别为N-乙酰半乳糖胺转移酶和半乳糖转移酶,将H物质分别转化为A抗原和B抗原。这种基因表达的复杂性,使得AB血型的遗传模式呈现出显性共显性特征,即父母若携带A和B基因,子女可能继承任意组合,从而形成AB血型。
值得注意的是,AB血型存在亚型分化。例如,A1和A2亚型在抗原表达强度上存在差异,而罕见的CisAB型则表现为A、B抗原基因位于同一染色体上的特殊遗传现象。这类亚型的存在,进一步揭示了AB血型系统的遗传多样性和生物学复杂性。
遗传规律与亲子鉴定争议
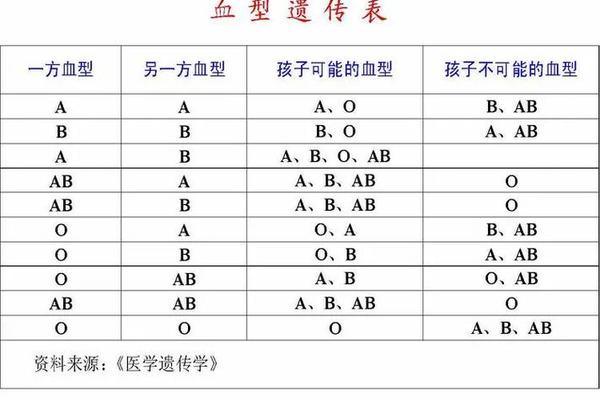
AB血型的遗传遵循孟德尔定律,但其特殊的显性共显性特征常引发亲子关系误判。根据常规遗传规律,若父母分别为A型(AO基因型)和B型(BO基因型),子女可能出现AB血型,概率为25%。实际案例中常出现例外情况。例如,父母一方为O型血,另一方为AB型血时,常规遗传规律认为子女不可能为AB型,但CisAB型的存在打破了这一理论。
CisAB型是一种罕见的遗传变异,其A、B抗原基因位于同一条染色体上,另一条染色体携带O基因。这种变异导致父母若一方为CisAB型,另一方为O型,子女仍可能表现为AB型血。2019年的一项研究显示,中国人群中CisAB型的发生率约为0.002%,这类案例常引发家庭矛盾,需通过DNA检测而非单纯血型比对进行亲子鉴定。
获得性B抗原现象也会干扰血型判断。某些肠道疾病或微生物感染可能导致红细胞表面出现类B抗原,使得A型血个体被误判为AB型。这提示临床血型检测需结合多维度分析,避免单一指标的局限性。
临床输血的双刃剑特性
传统观念将AB型血称为"万能受血者",因其红细胞缺乏对应抗体,理论上可接受任意血型的红细胞输入。但这种认知存在严重误区:AB型个体血清中虽无抗A、抗B抗体,供血者血浆中的抗体仍可能引发溶血反应。现代输血医学强调,除紧急情况外,必须严格遵循同型输血原则。
研究发现,AB型血患者接受异型输血时,即使少量输入也可能引发迟发性溶血反应。2018年《输血医学杂志》的统计显示,AB型异型输血的溶血反应发生率达0.7%,显著高于同型输血的0.03%。这与其血浆中存在的抗H抗体相关——当输入O型血时,供体红细胞表面的H抗原可能引发免疫反应。WHO明确建议将AB型血浆列为"危险血浆",禁止跨血型输注。
在器官移植领域,AB血型展现出特殊优势。由于抗原兼容性较广,AB型受体等待移植的时间较其他血型缩短30%。但这种优势伴随更高排异风险,研究显示AB型心脏移植患者的五年存活率较A型低8%,提示免疫调节机制仍需深入探索。
健康风险的遗传印记
AB血型与特定疾病的关联性已获多项研究证实。流行病学数据显示,AB型人群患冠状动脉心脏病的风险较O型高23%,这可能与其血浆中第八因子浓度偏高相关。第八因子作为凝血关键蛋白,浓度升高会导致血栓形成倾向,这与AB型基因调控的炎症因子表达模式密切相关。
认知功能方面,AB型人群晚年出现记忆力衰退的风险增加20%。美国REGARDS研究的跟踪调查发现,AB型被试者的第八因子平均浓度达129IU/dL,显著高于O型的98IU/dL。高浓度第八因子可能通过影响脑血管微循环,加速认知功能退化。AB型人群患精神分裂症的概率是其他血型的3.2倍,提示其神经系统发育存在特殊易感性。

值得注意的是,AB血型的免疫功能具有双重性。其NK细胞活性较A型高15%,对病毒感染的抵抗能力更强,但自身免疫性疾病发生率也相应增加。这种矛盾特征,可能源于A、B抗原对免疫细胞表面受体的差异化调控机制。
AB血型作为人类遗传多样性的典型代表,其生物学特性深刻影响着临床实践和个体健康。从分子机制到疾病风险,从输血安全到亲子鉴定,AB血型系统持续挑战着传统认知边界。现有研究虽已揭示部分规律,但关于CisAB型的形成机制、AB亚型的临床意义等问题仍需深入探索。
未来研究应聚焦三个方向:其一,建立AB亚型的标准化检测体系,完善稀有血型数据库;其二,探索基因编辑技术对AB血型相关疾病风险的干预可能;其三,开展跨种族大规模队列研究,解析环境与基因的交互作用。唯有通过多学科交叉研究,方能全面揭示AB血型系统的生物学奥秘,为精准医疗提供理论支撑。


