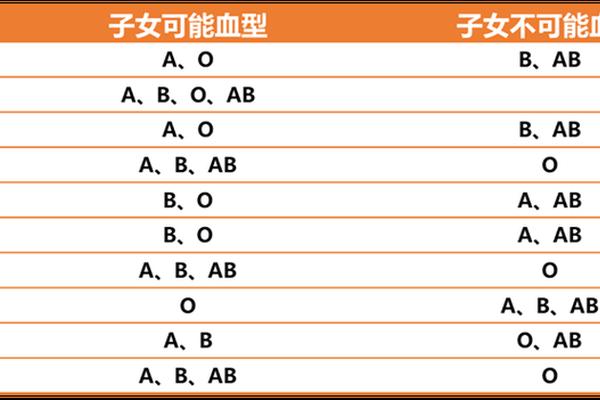
ABO血型系统作为人类最早发现且临床意义最为重要的血型系统,其分类基于红细胞表面A、B抗原的存在与否。根据遗传学规律,ABO血型由9号染色体上的IA、IB、i三个等位基因决定,其中IA和IB为共显性,i为隐性基因。常规的A型、B型、AB型和O型血型分别对应IAIA/IAi、IBIB/IBi、IAIB和ii的基因型,这种显隐性关系使得父母血型组合与子代血型之间存在明确的遗传规律。例如,B型血父亲(IBi)与O型血母亲(ii)的子代可能为B型或O型,但若母亲携带H基因缺陷(孟买血型),则可能打破常规遗传模式。
ABO系统的复杂性不仅限于常规分类。某些基因突变会导致抗原表达的异常,形成罕见亚型。例如,B(A)血型即由B等位基因发生单碱基突变(如ABOB(A).02),其编码的糖基转移酶兼具合成B抗原和微弱A抗原的能力,导致红细胞表面同时呈现强B抗原和弱A抗原。这种突变的发生率极低,在中国人群中约为1/5万至1/10万,其血清学特征常表现为正定型与反定型不符,易被误判为AB型或B型。
B(A)血型的分子机制与检测挑战
B(A)血型的分子机制源于ABO基因外显子区域的点突变。研究表明,B(A)04亚型的关键突变位点位于外显子7的c.796A>G(p.K266E),该突变使B型转移酶的活性发生改变,能够催化少量A抗原的合成。这种突变不影响H抗原的表达,因此B(A)型个体的血清中仍含有抗A抗体,但其红细胞上的微量A抗原可能引发交叉配血困难。
检测B(A)血型需结合血清学与分子生物学方法。常规血清学检测中,抗A试剂可能呈现弱凝集(++),而抗B呈强阳性(++++),易误判为AB型。此时需通过吸收放散试验或唾液血型物质检测排除获得性类B抗原干扰。基因测序作为“金标准”,可精准识别ABO基因的突变位点。例如,实时荧光定量PCR可检测A205、O261del等位基因,而高通量测序技术能全面分析外显子3-7的变异。研究显示,荧光定量PCR与基因测序的一致性高达90.4%,显著优于传统血清学方法(Kappa=0.503)。
临床输血与罕见血型管理的困境
B(A)血型的临床管理面临双重挑战。一方面,其血清学特征易导致血型误判。若将B(A)型误输给A型患者,微量A抗原可能触发受血者的抗A抗体,引发溶血反应。B(A)型作为供血者时,需严格匹配受血者血型。由于中国人群中B(A)型比例极低,血库中几乎无储备,常需跨地区调配或依赖自体输血。
基因分型技术的应用为精准输血提供了解决方案。与血清学相比,基因检测不受抗原减弱、自身抗体或药物干扰的影响,尤其适用于白血病患者、新生儿及移植后血型重塑的病例。例如,一项针对106例疑难血型的研究表明,基因测序成功纠正了12%的血清学误判病例,显著提升输血安全性。基因检测的高成本(约2000元/例)和操作复杂性限制了其临床普及。
未来研究方向与技术进步
未来研究需聚焦于三方面:其一,建立中国人群ABO亚型基因数据库,通过大规模测序揭示B(A)等罕见血型的流行病学特征;其二,开发低成本快速检测技术,如基于CRISPR的基因编辑工具或微流控芯片,实现床边血型基因分型;其三,探索血型抗原的免疫调节机制。例如,B(A)型个体对某些病原体(如诺如病毒)的易感性是否与A抗原表达相关,此类研究可为疫苗开发提供新思路。
血型基因编辑技术的突破可能改写输血医学规则。2023年,科学家利用碱基编辑技术将A型红细胞转化为O型,成功率达95%。若该技术应用于B(A)型,或可解决其输血资源短缺问题,但需严格评估脱靶效应和风险。
ABO血型系统的遗传复杂性与分子多样性深刻影响着临床实践。B(A)血型作为罕见亚型,其精准鉴定依赖基因测序技术,而输血安全亟需建立区域性稀有血型库。未来,随着基因检测成本的降低和人工智能辅助诊断的应用,血型管理将迈向个体化与精准化。建议医疗机构将基因分型纳入疑难血型常规检测流程,并通过多中心合作完善罕见血型资源共享机制,最终实现“零误差输血”的终极目标。


