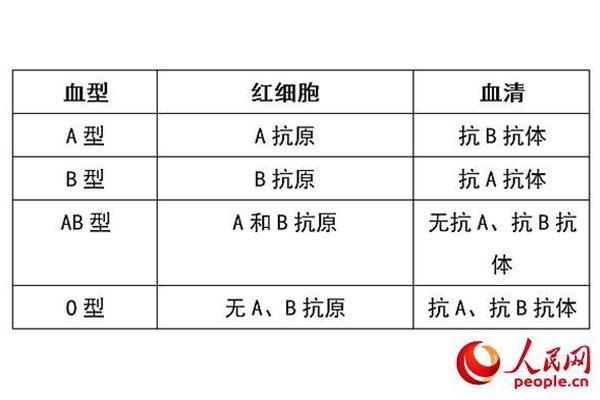
人类ABO血型系统的发现彻底改变了医学输血的安全性,而A型血作为其中占比最高的血型之一,其抗原与抗体的特性始终是研究焦点。A型血的红细胞表面携带A抗原,血清中则含有抗B抗体,这种独特的免疫学特征使其在输血、器官移植和疾病关联研究中占据重要地位。随着分子生物学的发展,A抗原的糖链结构、基因调控机制及其亚型差异逐渐被揭示,但临床实践中仍存在因抗原表达差异导致的误判风险。理解A型血的抗原抗体特性,不仅关乎个体健康管理,更是精准医疗的重要基础。
A抗原的分子结构与遗传基础
A抗原的化学本质是一种糖脂或糖蛋白复合物,其核心结构由H抗原(β-D-半乳糖、β-D-N-乙酰葡萄糖胺和α-L-岩藻糖)构成。通过A型基因(IA)编码的α-1,3-N-乙酰半乳糖胺转移酶作用,H抗原末端的半乳糖上被添加一个N-乙酰半乳糖胺基团,从而形成完整的A抗原。这种酶促反应具有高度特异性,其活性直接决定A抗原的表达强度。
基因层面,A型血的遗传遵循显性规律。IA等位基因存在显性纯合(IAIA)或杂合(IAi)两种形式,前者在汉族人群中占比超过99%,而IAi基因型则可能导致抗原表达量的细微差异。值得注意的是,某些罕见基因突变(如Ax、A3等亚型)会通过改变糖基转移酶的活性或底物亲和力,使A抗原呈现弱表达甚至缺失,这类现象在血型鉴定中易引发误判。
A型血清抗体的特性与功能
A型血个体的血清中天然存在抗B抗体(IgM型),这种抗体由肠道菌群中类似B抗原的糖类物质诱导产生。抗B抗体通过识别B抗原末端的半乳糖基团,触发补体介导的溶血反应,从而清除异源红细胞。实验表明,抗B抗体的效价与年龄相关,新生儿因免疫系统未成熟而效价较低,成年后可达1:64以上。
在临床输血中,A型血与B型血的免疫排斥正是源于这种抗原-抗体相互作用。例如,若将B型血输入A型个体,供体红细胞的B抗原会与受体的抗B抗体结合,导致红细胞凝集和溶解。值得注意的是,O型血虽无A/B抗原,但其血清中含抗A和抗B两种抗体,因此A型患者接受O型血时仍需警惕抗体残留引发的迟发性溶血反应。
A抗原亚型的临床意义
A型血存在超过20种亚型,其中A1和A2占总数的99.9%。A1亚型的红细胞同时表达A和A1抗原,而A2亚型仅表达A抗原,且抗原密度仅为A1的1/4-1/3。这种差异导致A2型红细胞与部分抗A1血清(如A2个体自身产生的抗体)可能发生凝集,从而在交叉配血试验中引发假阴性或假阳性结果。
亚型误判可能造成严重后果。例如,A2B型因抗原表达微弱,易被误判为B型;若将其输注给B型患者,供体残留的A抗原会与受体抗A抗体反应,引发急性溶血。血站常规检测中需采用单克隆抗A1试剂和吸收放散试验,以区分A1/A2亚型,尤其是对器官移植供受体匹配和新生儿溶血病风险评估具有关键意义。
抗原抗体相互作用的研究进展
近年来,分子模拟技术为解析A抗原-抗体相互作用提供了新视角。通过噬菌体展示技术筛选的模拟多肽(如EYWYCGMNRTGC),可与抗A抗体特异性结合,其亲和力与天然A抗原相似。这类合成多肽在血型试剂的标准化生产和溶血性疾病的体外诊断中展现出应用潜力。
基因编辑技术的突破则推动了血型抗原的精准调控。2023年,日本学者利用CRISPR-Cas9敲除HEK293细胞中的ABO基因,成功构建了无A抗原表达的细胞模型,该模型可用于研究A抗原在肿瘤转移和免疫逃逸中的作用。针对A亚型特异性表位的单克隆抗体(如MH04)已进入临床试验阶段,其检测灵敏度比传统试剂提高10倍以上。
A型血的抗原抗体系统是免疫血液学的经典研究对象,其分子机制和临床应用的深入研究,显著提升了输血安全性和疾病诊断准确性。现有技术对弱A亚型的识别仍存在局限,未来需开发基于质谱的糖链分析或纳米孔测序技术,实现抗原表达的定量检测。A抗原在胃癌、癌等恶性肿瘤中的异常表达现象提示其可能成为新的治疗靶点,相关机制值得进一步探索。
建议临床机构建立A亚型数据库,完善区域性血型分布图谱,同时加强公众对血型科学认知的教育。随着合成生物学和人工智能的交叉融合,定制化人工血液和智能血型匹配系统的出现或将彻底革新传统输血医学,而A型血的抗原特性研究将继续在这一进程中发挥基石作用。


