传统观念认为,血型是伴随终生的遗传特征,但现代医学研究发现,A型血在特定条件下确实可能发生改变。例如,在造血干细胞移植后,受体的造血系统被供体的干细胞替代,血型会逐渐转变为供体类型。临床案例显示,一名B型血白血病患者在接受A型供体的移植后,其血型最终转为A型。这种改变源于造血功能的系统性替换,属于血型的“长期改变”。肝脏移植也可能导致血型抗原的转变,因为肝脏是合成血型抗原的重要器官。
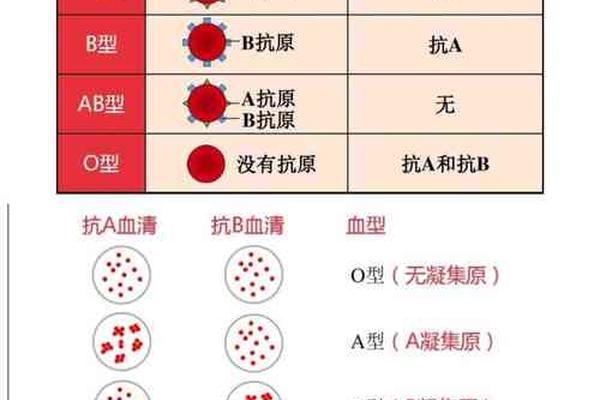
暂时性血型变化同样存在。妊娠期间母体可能短暂携带胎儿血型抗原,而某些血液疾病(如白血病)会削弱红细胞表面抗原的表达,导致检测结果呈现混合型或假性变化。例如,一名A型血结肠癌患者因肠道菌群紊乱产生类B抗原,血型检测显示AB型特征,但随着病情缓解,抗原恢复为A型。这些案例表明,血型变化的本质是抗原表达的生理或病理性波动,而非基因层面的改变。
A型血与疾病风险的关联
多项研究表明,A型血与心血管疾病风险存在显著关联。美国心脏协会数据显示,A型血人群心脏病发作风险较O型血高8%,心力衰竭风险高10%。其机制可能与A抗原促进炎症反应有关,导致血管内皮损伤和脂质沉积加速。A型血凝血因子Ⅷ和血管性血友病因子水平较高,进一步增加血栓形成概率。
癌症风险方面,A型血人群的胃癌和癌发病率显著高于其他血型。上海一项长达20年的队列研究发现,A型血消化系统肿瘤风险增加12%,可能与A抗原与肿瘤细胞表面糖蛋白的分子模拟有关,削弱免疫监视功能。这种关联性并非绝对。日本作为A型血比例最高的国家之一,其胃癌发病率却因饮食习惯(低盐、高纤维)而显著低于全球平均水平,提示环境因素对疾病风险的调控作用。
影响寿命的多维因素
早期研究曾提出A型血平均寿命较短的观点。美国一项针对5000人的调查显示,A型血平均寿命为62岁,显著低于O型血的87岁。但该结论存在局限性:样本量较小且未控制混杂变量。更大规模的队列研究(如涉及60万人的中风风险分析)发现,A型血早发中风风险虽高,但通过控制血压和血脂可降低42%的疾病负担。
寿命差异的本质是疾病风险的累积效应,而非血型本身决定寿命长短。芬兰学者通过基因组关联分析发现,ABO基因位点与代谢调节相关,但仅能解释约3%的疾病易感性差异。更重要的是,健康行为可逆转遗传劣势。例如,A型血人群通过地中海饮食(富含ω-3脂肪酸)可将心血管死亡率降低30%,而定期运动能改善血液粘稠度,使预期寿命延长5-7年。
科学争议与研究展望
当前血型与寿命关系的研究存在方法论争议。病例对照研究容易受到回忆偏倚影响,而孟德尔随机化分析虽能减少混杂因素干扰,却难以完全解释基因-环境交互作用。例如,ABO基因同时影响肠道菌群构成,而菌群代谢物(如氧化三甲胺)可能独立介导动脉粥样硬化进程。这种复杂的生物网络使得单一血型因素的效应评估充满挑战。
未来研究需在三个方向突破:一是建立多组学联合分析模型,整合基因组、代谢组和蛋白质组数据,揭示血型影响健康的分子通路;二是开展跨种族队列研究,消除地域和饮食文化的干扰;三是探索个性化干预策略,例如针对A型血人群设计抗炎靶向药物。2024年《自然》期刊提出的血液生物标志物动态监测方案,为实时评估血型相关疾病风险提供了新技术路径。
A型血的变化可能性仅限于特定医疗场景,而其对寿命的影响本质是疾病易感性的统计学关联。现有证据表明,通过生活方式干预(如低脂饮食、压力管理)可有效中和遗传风险。科学界需摒弃“血型决定论”的简单化思维,转而关注基因与环境互作的动态过程。对于个体而言,定期体检(尤其是心血管和肿瘤标志物筛查)比关注血型更有实际意义。未来的精准医学或将结合血型特征制定差异化健康管理方案,但现阶段,主动的健康行为仍是延长寿命的核心策略。


