在人类复杂的免疫系统中,血型抗原与抗体的相互作用犹如精密的生物识别系统。ABO血型系统的发现揭开了输血医学的序幕,但其中的免疫学机制至今仍在持续引发科学界的探索兴趣。当A型血人群的血清中意外出现抗A凝集素,或检测报告提示"抗a凝集"现象时,这些看似矛盾的生物学现象实则蕴含着血型系统运作的深层逻辑。从抗原表位变异到抗体识别机制,从常规检测误差到特殊血型亚型,每个发现都在重塑着我们对血液免疫学的认知边界。
ABO血型系统的免疫学基础
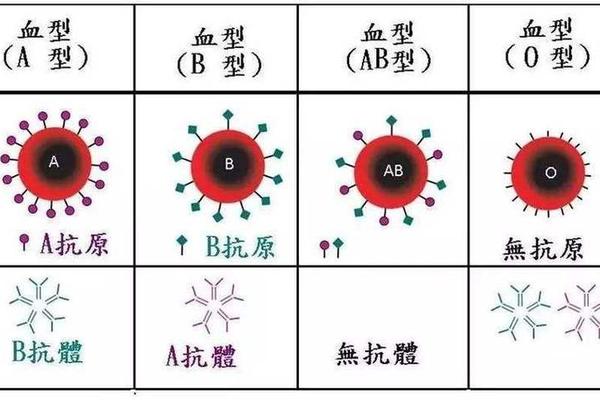
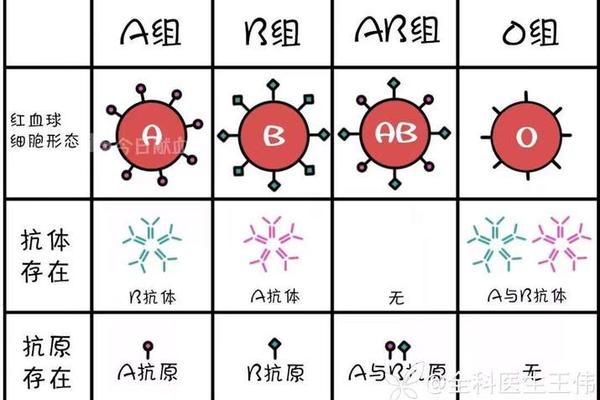
ABO血型系统的核心在于红细胞表面抗原与血浆抗体的动态平衡。A型血的红细胞表面携带A抗原,其本质是在H抗原基础上添加N-乙酰半乳糖胺的糖基化产物。这种抗原的形成依赖于特定的糖基转移酶活性,而基因突变可能导致酶活性的部分缺失,形成A亚型。正常情况下,A型个体血浆中仅存在抗B抗体,这是免疫系统对环境中类B抗原物质产生免疫耐受的结果。
天然抗体的形成机制是理解ABO系统的关键。婴儿出生后6-12个月内,通过接触环境中微生物表面与血型抗原相似的糖链结构,逐步建立起针对非自身抗原的抗体系统。这种抗体属于IgM类型,在盐水介质中即可引发红细胞凝集,其产生过程不依赖输血或妊娠等免疫刺激,因而被称为"天然抗体"。对于A型个体而言,免疫系统通过中枢耐受机制清除可能攻击自身A抗原的B细胞克隆,确保抗体系统的特异性。
抗A现象的特殊病理机制
临床上偶见的A型血抗A现象往往提示着免疫系统的异常状态。在造血干细胞移植案例中,接受O型供体的A型患者可能形成"混合场凝集",即患者自身残留的A型红细胞与新生O型红细胞共存,同时血浆中检测到抗A抗体。这种嵌合状态下的免疫重建可能打破原有的耐受平衡,导致自身抗体的异常产生。
某些血液系统疾病也会引发抗原-抗体关系的改变。急性白血病患者可能因基因表达异常导致红细胞抗原减弱,同时出现针对自身抗原的抗体。在冷凝集素综合征中,IgM型冷抗体在低温条件下与红细胞发生可逆性结合,可能干扰常规血型检测结果,造成假性抗A凝集现象。这些特殊病例提示,血型系统的稳定性可能受到多种病理因素的挑战。
抗a凝集的检测学解析
抗a凝集"的检测报告需要结合实验方法进行细致解读。在试管法中,37℃孵育后观察到的凝集多为IgG抗体所致,而4℃出现的凝集则提示IgM型冷抗体的干扰。微柱凝胶技术的应用显著提高了检测灵敏度,但同时也增加了弱抗体检出的可能性。对于某些特殊样本,可能需要联合使用蛋白酶处理、抗人球蛋白试验等补充检测手段。
检测误差是造成矛盾结果的重要原因。当抗A试剂效价过高时,可能与非特异性物质发生交叉反应;而血浆蛋白异常或纤维蛋白原增高可能模拟凝集现象。在临床实践中,遇到ABO正反定型不符时,需要排查样本污染、试剂失效、技术操作等因素,必要时进行基因分型确认。近年发展的微流控纸基检测技术,通过抗原抗体反应的可视化判读,为快速准确的血型鉴定提供了新思路。
输血安全与精准医疗
血型系统的复杂性对临床输血提出了更高要求。交叉配血试验中,既要防止主侧凝集导致的急性溶血反应,也要关注次侧凝集提示的潜在免疫风险。对于存在自身抗体的患者,选择去白细胞的洗涤红细胞可降低输血反应发生率。在新生儿溶血病防治中,O型母亲血清中的IgG型抗A抗体效价监测,直接影响着胎儿宫内输血时机的选择。
分子诊断技术的发展正在重塑血型检测的临床路径。通过PCR-SSP技术可准确识别ABO基因的突变位点,解决血清学无法判定的疑难血型。质谱分析技术的应用,使得红细胞膜表面抗原的糖链结构解析成为可能,为理解抗原变异提供了分子层面的依据。这些技术进步不仅提高了输血安全性,也为个体化医疗开辟了新方向。
从Landsteiner发现ABO血型至今,人类对血液免疫学的认知已跨越百年。当现代检测技术揭示出抗A抗体与"抗a凝集"背后的复杂机制时,我们愈加认识到生命系统的精妙与脆弱。未来研究需要深入探索血型抗原的表观遗传调控、抗体产生的分子开关机制,以及新型纳米检测技术的临床应用潜力。唯有持续深化对血型系统本质的理解,才能在精准医疗时代为患者构筑更安全的生命防线。


