在血型遗传的复杂图谱中,父母一方为A型血、子女却出现Rh阴性(俗称“熊猫血”)的现象,本质上是ABO血型系统与Rh血型系统独立遗传的结果。ABO血型的A基因位于第9号染色体,而Rh血型的D抗原基因位于第1号染色体,两者互不干扰。A型血父母完全可能携带隐性的Rh阴性基因(d),并通过遗传组合使子女表现为Rh阴性。
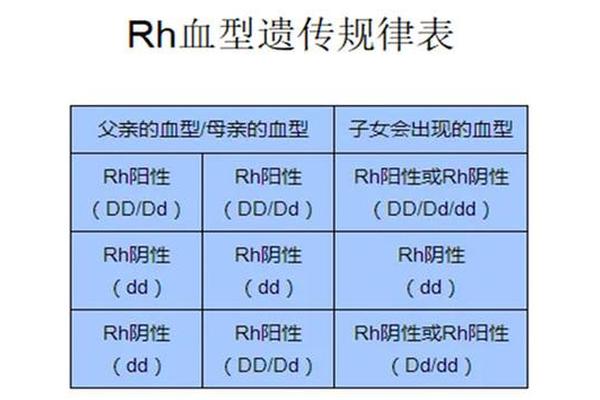
从遗传规律来看,Rh阴性属于隐性性状,只有当个体从父母双方各继承一个隐性基因(dd)时才会表现出来。例如,若父母均为Rh阳性但携带隐性d基因(即基因型为Dd),子女有25%的概率为Rh阴性;若父母一方为Rh阴性(dd),另一方为Rh阳性携带者(Dd),子女则有50%的概率为Rh阴性。即使父母表面为普通A型血,只要携带隐性d基因,便可能生育出Rh阴性的后代。
值得注意的是,ABO血型与Rh血型的组合具有多样性。例如,父母一方为A型Rh阳性(Dd),另一方为O型Rh阳性(Dd),子女可能是A型、O型或其他ABO血型,同时仍有概率继承dd组合成为Rh阴性。这种遗传独立性解释了为何A型血家族中可能出现“熊猫血”成员,并提示血型检测需同时关注ABO和Rh两大系统。
二、医学挑战与应对
Rh阴性血型的稀有性(中国汉族人群占比约0.3%)使其在临床上面临严峻挑战。输血安全需严格匹配:Rh阴性患者若输入Rh阳性血液,体内可能产生抗D抗体,导致溶血反应,严重时可危及生命。例如,2019年陕西一名A型Rh阴性民警因车祸急需输血,血站不得不紧急调用稀有血源,这凸显了血库储备的重要性。
孕期管理尤为关键。Rh阴性孕妇若怀有Rh阳性胎儿,胎儿的红细胞可能通过胎盘进入母体,诱发免疫反应。首次妊娠通常风险较低,但后续妊娠中母体抗体可能攻击胎儿红细胞,导致新生儿溶血病。医学界建议Rh阴性孕妇在妊娠28周及分娩后72小时内注射抗D免疫球蛋白,以阻断抗体形成。
近年来,技术进步为稀有血型患者带来希望。例如,2024年浙江大学邵逸夫医院为一名B型Rh阴性合并多重抗体的肝硬化患者实施肝移植时,采用回收式自体输血技术,将术中流失血液净化后回输,减少了对异体血的需求。此类创新为稀有血型手术提供了新思路。
三、社会支持与献血机制
建立高效的稀有血型互助网络是解决问题的核心。中国多地已成立“熊猫血”志愿组织,例如山东泰安的“熊猫女侠”辛风荣,连续6年献血2400毫升,并带动亲属参与献血,成功救治多名患者。这些组织通过实时联络、定期献血活动,构建起动态血源储备池。
公众教育同样不可或缺。许多Rh阴性者直至生育或手术前才知晓自身血型,错失了提前储备自体血的机会。血型科普需纳入常规体检项目,并加强遗传咨询。例如,建议有家族史的人群进行扩展血型检测(包括RhCE抗原),以发现更罕见的亚型(如dCCee型)。
政策层面,部分国家已立法要求血站建立稀有血型数据库。中国可借鉴此类经验,通过数字化管理实现跨区域血源调配。例如,浙江省血液中心在2024年一例肝移植手术中,从全省库存筛选出1.5单位匹配血液,并与外省联动调入4单位O型dCCee红细胞,展现了系统化管理的潜力。
四、未来研究方向
基因技术的突破可能改写稀有血型医疗史。CRISPR基因编辑已在实验室中成功将Rh阳性红细胞转化为Rh阴性,未来或能人工合成通用型血液。干细胞定向分化为红细胞的技术,可使Rh阴性者自体干细胞生成所需血液,从根本上解决血源短缺。
在遗传学层面,需进一步探索Rh阴性基因的地域分布规律。例如,白种人Rh阴性比例高达15%,而亚洲人群不足1%,这种差异可能与自然选择或基因漂变相关。大规模基因组研究或能揭示其进化机制,为疾病预防提供依据。
父母一方为A型血却生育Rh阴性子女的现象,揭示了血型遗传的复杂性与独立性。从隐性基因传递到临床输血风险,从社会互助网络到基因技术前景,这一课题融合了生物学、医学和社会学的多维视角。未来,通过完善血库体系、推进基因研究、加强公众教育,人类有望将“熊猫血”从医学难题转化为可控风险,最终实现“血型无碍生命”的理想图景。建议、医疗机构与公众三方协同,将稀有血型管理纳入公共卫生战略,同时鼓励科研机构探索长效解决方案,如人工血液合成技术的临床应用。


