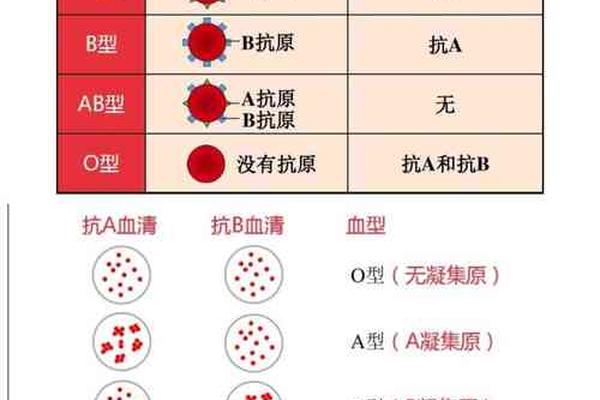
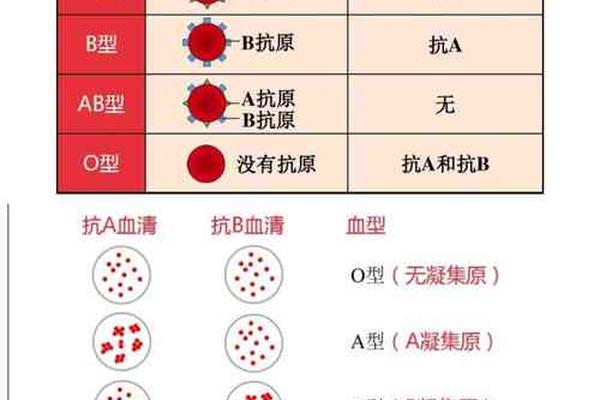
ABO血型系统是人类最早被发现且临床意义最为显著的血型分类体系,其核心在于红细胞表面抗原与血清中抗体的特异性识别。A型血作为该系统的重要组成部分,其定义为红细胞膜上携带A抗原,同时血清中存在抗B抗体。这一分类基于免疫学原理:A抗原是一种由N-乙酰半乳糖胺组成的糖蛋白结构,而抗B抗体则属于IgM类免疫球蛋白,能够与B型红细胞表面的半乳糖抗原发生凝集反应。值得注意的是,ABO血型的遗传遵循孟德尔定律,A型个体的基因型可能是AA或AO,其中O基因作为隐性基因不会影响A抗原的表达。
抗原与抗体的动态平衡是ABO血型系统稳定性的关键。例如,A型血个体的抗B抗体并非先天存在,而是在出生后通过接触环境中与B抗原相似的微生物糖类结构逐渐形成。这种后天免疫机制解释了为何新生儿血型鉴定需谨慎,其抗体效价可能不足,需结合正反定型综合判断。抗原的表达强度可能受疾病影响,例如白血病或造血干细胞移植可能导致A抗原暂时性减弱,此时需通过分子生物学方法辅助确认。
二、A型血的血清学鉴定方法
传统的A型血鉴定主要依赖血清学技术,包括正向定型与反向定型的双重验证。正向定型通过已知的抗A单克隆抗体与待测红细胞反应,若出现凝集现象则确认A抗原的存在。反向定型则利用已知的B型标准红细胞检测血清中的抗B抗体,两者结果一致方可判定为A型。例如,玻片法操作简便但灵敏度较低,适用于大规模筛查;而试管法通过离心加速抗原-抗体结合,可检测到弱凝集反应,更适用于临床疑难样本。
现代技术如流式细胞术和凝胶微柱法的应用显著提升了检测精度。流式细胞术通过荧光标记抗体定量分析抗原表达强度,能有效识别A亚型(如A1与A2),其灵敏度可达传统方法的100倍以上。凝胶微柱法则利用分子筛原理,将红细胞与抗体的反应可视化,避免了人为判读误差,已被世界卫生组织推荐为标准化检测方案。这些技术的进步使A型血的误诊率从早期的1.2%降至0.05%以下。
三、临床实践中的挑战与解决方案
尽管ABO血型鉴定技术日趋成熟,临床仍面临多重挑战。约0.1%的A型样本属于亚型,如A3或Ax型,其抗原表达微弱,常规血清学检测易误判为O型。研究显示,采用基因测序技术检测ABO基因第6、7外显子突变,可准确识别这些罕见亚型,避免输血事故。疾病状态可能干扰鉴定结果:系统性红斑狼疮患者的红细胞膜修饰可能掩盖A抗原,而造血干细胞移植后供体血型基因的表达会导致血型转换。
针对这些复杂情况,国际输血协会建议采用三级验证流程:初筛使用自动化仪器进行血清学检测,疑难样本追加分子生物学分析,最终通过基因分型确认。例如,无锡血站通过建立荧光PCR检测体系,成功解决了2例ABO亚型鉴定难题,将检测周期从72小时缩短至6小时。这种多技术联用策略已被证明可将临床输血反应发生率降低至0.003%以下。
四、未来研究方向与技术革新
血型鉴定的未来发展聚焦于精准医疗与技术创新。一方面,基于CRISPR-Cas9的基因编辑技术正在探索血型抗原的人工改造,例如通过酶解法将A型红细胞转化为通用O型,这一突破已在动物实验中实现80%的抗原清除率。人工智能辅助诊断系统的开发可整合血清学、基因组学与临床数据,实现血型鉴定的实时动态监测。丹麦学者最近发现肠道菌群中的特定酶类可能参与血型抗原代谢,这为开发口服血型调节剂提供了新思路。
分子诊断技术的微型化与便携化也值得关注。美国FDA于2024年批准的首款手持式血型分析仪,通过纳米生物传感器可在5分钟内完成ABO-Rh联合检测,准确率达99.8%,特别适用于灾害医学与战地急救。表观遗传学研究揭示DNA甲基化可能影响ABO基因表达,这为探索环境因素与血型相关性开辟了新领域。
ABO血型系统中的A型鉴定不仅关乎个体身份识别,更是临床安全输血的核心保障。从抗原-抗体的免疫学基础到分子水平的基因解析,技术的迭代不断深化着人类对血型本质的认知。当前研究证实,传统血清学方法需与基因检测相结合,方能应对亚型、疾病干扰等复杂场景。未来,随着合成生物学与人工智能的深度融合,血型鉴定将迈向个性化、动态化的新阶段。建议医疗机构建立多学科协作平台,整合血清学、基因组学与临床数据,同时加强公众科普,消除“万能血型”等认知误区,共同构建更安全的输血医疗体系。


